题目内容
 铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题:
铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题:(1)基态Cu原子的外围电子排布式为
(2)很多不饱和有机物在Ni催化下可与H2发生加成反应,如①CH2=CH2②HC≡CH ③
 ④HCHO,其中碳原子采取sp2杂化的分子有
④HCHO,其中碳原子采取sp2杂化的分子有(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为
(4)向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是
A.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
B.[Cu(NH3)4]SO4组成元素中,N、O、S第一电离能大小顺序是O>N>S
C.[Cu(NH3)4]SO4 所含有的化学键有离子键、极性键和配位键
D.NH3分子和H2O分子的空间构型不同,且氨气分子的键角小于水分子的键角
(5)已知CuH的晶体结构如图所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
考点:晶胞的计算,原子核外电子排布,判断简单分子或离子的构型,配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)铜是29号元素,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;
(2)根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数;
根据杂化轨道方式及杂化轨道成键情况判断HCHO立体结构;
(3)Ni(CO)4中配体是CO,CO的等电子体是与其原子个数相等且价电子数相等的分子或离子;
(4)根据的[Cu(NH3)4]SO4结构判断选项;
(5)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式计算.
(2)根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数;
根据杂化轨道方式及杂化轨道成键情况判断HCHO立体结构;
(3)Ni(CO)4中配体是CO,CO的等电子体是与其原子个数相等且价电子数相等的分子或离子;
(4)根据的[Cu(NH3)4]SO4结构判断选项;
(5)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式计算.
解答:
解:(1)铜是29号元素,其原子核外有29个电子,根据构造原理知可得Cu基态原子核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2))①CH2=CH2中碳原子成2个C-Hδ键,1个碳碳双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化.
②CH≡CH中碳原子成2个C-Hδ键,1个碳碳三键,三键中含有1个δ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化.
③苯中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化.
④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化.
故①、③、④采取sp2杂化.
HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成δ键,参与成键的原子不同,所以HCHO为平面三角形.
故答案为:①③④;平面三角形.
(3)CO分子中含有2个原子,其价电子个数是10,所以与Ni(CO)4中配体互为等电子的离子是CN-;
故答案为:CN-;
(4)A、NH3分子和H2O分子之间形成4种不同的氢键,故A错误;
B、[Cu(NH3)4]SO4组成元素中,其第一电离能大小顺序是N>O>S,故B错误;
C、N与H原子形成极性共价键,[Cu(NH3)4]2+与SO42-形成离子键,Cu2+与NH3形成配位键,故C正确;
D、氨气分子的键角小于水分子的键角,故D错误.
故答案为:C;
(5)该晶胞中含有4个H原子,铜原子个数=8×
+6×
=4,所以该晶胞中含有4个铜原子4个氢原子,设该晶胞的边长为a,则d=
,所以a=
.
故答案为:
.
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2))①CH2=CH2中碳原子成2个C-Hδ键,1个碳碳双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化.
②CH≡CH中碳原子成2个C-Hδ键,1个碳碳三键,三键中含有1个δ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化.
③苯中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化.
④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化.
故①、③、④采取sp2杂化.
HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成δ键,参与成键的原子不同,所以HCHO为平面三角形.
故答案为:①③④;平面三角形.
(3)CO分子中含有2个原子,其价电子个数是10,所以与Ni(CO)4中配体互为等电子的离子是CN-;
故答案为:CN-;
(4)A、NH3分子和H2O分子之间形成4种不同的氢键,故A错误;
B、[Cu(NH3)4]SO4组成元素中,其第一电离能大小顺序是N>O>S,故B错误;
C、N与H原子形成极性共价键,[Cu(NH3)4]2+与SO42-形成离子键,Cu2+与NH3形成配位键,故C正确;
D、氨气分子的键角小于水分子的键角,故D错误.
故答案为:C;
(5)该晶胞中含有4个H原子,铜原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
| 3 |
| ||
故答案为:
| 3 |
| ||
点评:本题考查了原子核外电子排布式的书写、原子杂化方式的判断、晶胞计算等知识点,根据构造原理价层电子对互斥理论来分析解答即可,难度中等.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A、1mol Na加热时与O2反应失去的电子数目为NA |
| B、92g N2O4和92g NO2含有的原子数均为6NA |
| C、1L 0.1mol?L-1的盐酸中,所含HCl分子数为0.1NA |
| D、标准状况下,22.4L O3中含3NA个氧原子 |
下列各方程式中,属于水解反应的是( )
| A、HCO3-+H2O?H2CO3+OH- |
| B、HCO3-+H2O?CO32-+H3O+ |
| C、HCO3-+OH-?CO32-+H2O |
| D、CO32-+H+=HCO3- |
一个原电池的总反应是:Cu+2Fe3+═Cu2++2Fe2+,该原电池的正确组成是( )
| A | B | C | D | |
| 正极 | Fe | Cu | Cu | C |
| 负极 | Cu | C | Fe | Cu |
| 电解质溶液 | Fe2(SO4)3 | Fe2(SO4)3 | CuSO4 | Fe2(SO4)3 |
| A、A | B、B | C、C | D、D |
配制250mL1mol/L的稀盐酸溶液,需要12mol/L的浓盐酸的体积为( )
| A、12mL | B、25mL |
| C、21mL | D、12.5mL |
下列说法正确的是( )
| A、炔烃可以使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色 |
| B、某有机物燃烧只生成等物质的量的CO2和H2O,则此有机物的组成为CnH2n |
| C、鉴定溴乙烷中溴原子的存在的实验操作是:向溴乙烷中加入NaOH溶液,加热后加入AgNO3溶液 |
D、在分子 中,处于同一平面上的碳原子最多可能有12个 中,处于同一平面上的碳原子最多可能有12个 |
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A、铅笔端有少量的氯气产生 |
| B、a点是正极,b点是负极 |
| C、铂片端作阳极,发生氧化反应 |
| D、铅笔端作阳极,发生还原反应 |
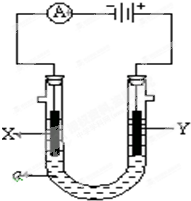 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: