题目内容
 如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置. (提示:在酸性条件下MnO4-被还原为Mn2+)
如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置. (提示:在酸性条件下MnO4-被还原为Mn2+)(1)仪器a的名称是:
(2)写出装置A中发生的化学反应方程式:
(3)装置C的作用分别是
(4)请写出在D中发生的离子反应方程式:
(5)根据此实验装置设计实验,可证实MnO4-、Br2、Cl2三者氧化性的强弱:在B中加入
考点:氯气的实验室制法,氧化性、还原性强弱的比较
专题:氧化还原反应专题,卤族元素
分析:(1)熟悉常见仪器的名称;
(2)高锰酸钾与浓盐酸反应生成氯气、氯化钾、氯化锰和和水;
(3)依据氯气易溶于氢氧化钠的性质解答;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(5)高锰酸钾与盐酸反应生成氯气、氯化钾、氯化锰和和水,反应中高锰酸钾为氧化剂,氯气为氧化产物;氯气与溴化钠溶液反应生成溴单质与氯化钠,反应中氯气为氧化剂,溴单质为氧化产物,据此解答.
(2)高锰酸钾与浓盐酸反应生成氯气、氯化钾、氯化锰和和水;
(3)依据氯气易溶于氢氧化钠的性质解答;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(5)高锰酸钾与盐酸反应生成氯气、氯化钾、氯化锰和和水,反应中高锰酸钾为氧化剂,氯气为氧化产物;氯气与溴化钠溶液反应生成溴单质与氯化钠,反应中氯气为氧化剂,溴单质为氧化产物,据此解答.
解答:
解:(1)仪器a的名称是:分液漏斗;
故答案为:分液漏斗;
(2)高锰酸钾与浓盐酸反应生成氯气、氯化钾、氯化锰和和水,化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;
故答案为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;
(3)氯气易溶于氢氧化钠溶液,导管直接插入烧杯中,容易发生倒吸,装置C为安全瓶,可以防止倒吸;
故答案为:防止倒吸;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+OH-═Cl-+ClO-+H2O;
故答案为:Cl2+OH-═Cl-+ClO-+H2O;
(5)高锰酸钾与盐酸反应生成氯气、氯化钾、氯化锰和和水,反应中高锰酸钾为氧化剂,氯气为氧化产物;氯气与溴化钠溶液反应生成溴单质与氯化钠,反应中氯气为氧化剂,溴单质为氧化产物,依据氧化剂的氧化性大于氧化产物的氧化性,所以氧化性顺序为:MnO4->Cl2>Br2,
故答案为:NaBr;有黄绿色气体生成;溶液由无色变成橙色(或橙红色、橙黄色);MnO4->Cl2>Br2.
故答案为:分液漏斗;
(2)高锰酸钾与浓盐酸反应生成氯气、氯化钾、氯化锰和和水,化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;
故答案为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;
(3)氯气易溶于氢氧化钠溶液,导管直接插入烧杯中,容易发生倒吸,装置C为安全瓶,可以防止倒吸;
故答案为:防止倒吸;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+OH-═Cl-+ClO-+H2O;
故答案为:Cl2+OH-═Cl-+ClO-+H2O;
(5)高锰酸钾与盐酸反应生成氯气、氯化钾、氯化锰和和水,反应中高锰酸钾为氧化剂,氯气为氧化产物;氯气与溴化钠溶液反应生成溴单质与氯化钠,反应中氯气为氧化剂,溴单质为氧化产物,依据氧化剂的氧化性大于氧化产物的氧化性,所以氧化性顺序为:MnO4->Cl2>Br2,
故答案为:NaBr;有黄绿色气体生成;溶液由无色变成橙色(或橙红色、橙黄色);MnO4->Cl2>Br2.
点评:本题考查了氯气的制备和性质的检验,题目难度不大,熟悉反应原理和氯气的性质是解题关键,注意氧化性强弱判断方法.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A、10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C、10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
| D、10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
下列各方程式中,属于水解反应的是( )
| A、HCO3-+H2O?H2CO3+OH- |
| B、HCO3-+H2O?CO32-+H3O+ |
| C、HCO3-+OH-?CO32-+H2O |
| D、CO32-+H+=HCO3- |
配制250mL1mol/L的稀盐酸溶液,需要12mol/L的浓盐酸的体积为( )
| A、12mL | B、25mL |
| C、21mL | D、12.5mL |
以下对实验操作的说法正确的是( )
| A、配制FeCl3溶液时,应将FeCl3溶解在适量的盐酸中 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、用CCl4萃取碘水中的I2时,有机层从分液漏斗的下端放出 |
| D、酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |
下列说法正确的是( )
| A、炔烃可以使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色 |
| B、某有机物燃烧只生成等物质的量的CO2和H2O,则此有机物的组成为CnH2n |
| C、鉴定溴乙烷中溴原子的存在的实验操作是:向溴乙烷中加入NaOH溶液,加热后加入AgNO3溶液 |
D、在分子 中,处于同一平面上的碳原子最多可能有12个 中,处于同一平面上的碳原子最多可能有12个 |
下列说法正确的是( )
| A、二氧化碳溶于水可以导电,所以二氧化碳是电解质 |
| B、液态氯化氢不能导电,所以氯化氢是非电解质 |
| C、Na2O2与水反应能生成碱,所以它是碱性氧化物 |
| D、FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
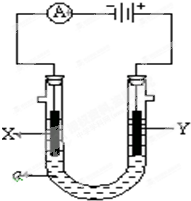 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: