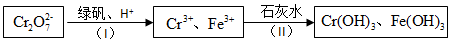题目内容
3.某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体.(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性.
请写出Ca在空气中燃烧发生反应的化学方程式:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C.
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:2CaO2+2H2O═2Ca(OH)2+O2↑ Ca3N2+6H2O═3Ca(OH)2+2NH3↑.
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2).臭氧还原为氧气.反应式为:O3+2KI+H2O=O2+I2+2KOH【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有O3;
假设3:该臭味气体含有NH3和O3.
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验.请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选).
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水.设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论.
| 实验操作 | 预期现象和结论 |
| 取少量反应后固体于试管中,向试管中加入少量水, 将湿润的红色石蕊试纸置于试管口; 另取少量反应后固体于试管中,向试管中加入少量水, 将产生气体通入淀粉-KI溶液中. |
分析 (1)Ca与Mg是同一主族元素,化学性质具有一定的相似性,根据Mg在空气中的燃烧分析,Mg在空气中燃烧,可与O2、N2、CO2反应,所以Ca也能与O2、N2、CO2反应,进而写出化学方程式;
(2)CaO2类比Na2O2,写出化学方程式,CaO2与水反应生成氧气和氢氧化钙,Ca2N3与水反应生成氨气和氢氧化钙;
【提出假设】CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3,只含有一种或两种都有,该臭味气体只有O3;该臭味气体含有O 3和NH3;
(3)根据氨气溶于水显碱性和臭氧的强氧化性设计实验,来验证二者的存在,NH3溶于水显碱性,可用湿润的红色湿润试纸检验是否含NH3,利用O3具有强氧化性,可用淀粉-KI溶液检验是否含O3.
解答 解:(1)Ca与Mg是同一主族元素,化学性质具有一定的相似性,已知Mg与空气中的氧气、二氧化碳及氮气均反应,则Ca也可以,所以Ca在空气中燃烧发生反应的化学方程式为:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C;
故答案为:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C;
(2)CaO2与水反应生成氧气和氢氧化钙,其反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑,Ca3N2与水反应生成氨气和氢氧化钙,其反应方程式为:Ca3N2+6H2O═3Ca(OH)2+3NH3↑;
故答案为:2CaO2+2H2O═2Ca(OH)2+O2↑ Ca3N2+6H2O═3Ca(OH)2+2NH3↑;
【提出假设】只含有一种或两种都有;即假设该臭味气体只有O3,假设该臭味气体含有NH3和O3,
故答案为:O3;NH3和O3;
(3)已知氨气溶于水显碱性,所以可用湿润的红色石蕊试纸来检验是否含有氨气,臭氧的强氧化性能使淀粉-KI溶液变蓝色,所以可以用淀粉-KI溶液检验是否含有臭氧,其实验操作为:
| 实 验 操 作 | 预 期 现 象 与 结 论 |
| 取少量反应后固体于试管中,向试管中加入少量水,将湿润的红色石蕊试纸置于试管口; 另取少量反应后固体于试管中,向试管中加入少量水,将产生气体通入淀粉-KI溶液中; | 若红色石蕊试纸显蓝色,且淀粉-KI溶液不变色 则假设1成立; 若红色石蕊试纸不显蓝色,且淀粉-KI溶液变蓝色,则假设2成立; 若红色石蕊试纸显蓝色,且淀粉-KI溶液变蓝色,则假设3成立; |
故答案为:
| 实 验 操 作 | 预 期 现 象 与 结 论 |
| 取少量反应后固体于试管中,向试管中加入少量水,将湿润的红色石蕊试纸置于试管口; 另取少量反应后固体于试管中,向试管中加入少量水,将产生气体通入淀粉-KI溶液中; | 若红色石蕊试纸显蓝色,且淀粉-KI溶液不变色 则假设1成立; 若红色石蕊试纸不显蓝色,且淀粉-KI溶液变蓝色,则假设2成立; 若红色石蕊试纸显蓝色,且淀粉-KI溶液变蓝色,则假设3成立; |
点评 本题以Mg和Ca的性质的相似性为知识背景,考查了学生实验探究能力,同时考查了学生对常见物质检验方法的掌握情况,题目难度中等,注意根据物质的性质设计实验操作.

| A. | 具有相同的质子数 | B. | 具有相同的中子数 | ||
| C. | 具有相同的质量数 | D. | 它们不互为同位素 |
| A. | 干冰只能用于人工降雨 | |
| B. | Al(OH)3可以治疗胃酸过多,因此可大量使用 | |
| C. | 为了增强去污效果,在洗衣粉中添加三聚磷酸钠(Na5P3O10) | |
| D. | 侯氏制碱法不涉及基本反应类型中的置换反应 |
| X | ||
| M | Y | Z |
| A. | 氢化物沸点最高的是H2X | B. | M4的摩尔质量为124 | ||
| C. | X、Y、Z的简单离子半径最大的是Z | D. | X、Y两种元素,化合价都可以显-1价 |
 转变为
转变为 ,应用的试剂是( )
,应用的试剂是( )| A. | 盐酸 | B. | CO2 | C. | NaHCO3溶液 | D. | NaOH溶液 |
| A. | MgO | B. | Al2O3 | C. | SiO2 | D. | Al(OH)3 |
| A. | 标准状况下,11.2 L HF中含有分子的数目为0.5 NA | |
| B. | 0.1 mol Fe与少量氯气反应生成FeCl2,转移电子数为0.2 NA | |
| C. | 1.4 g由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3 NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |