题目内容
19.化学与社会、生产、生活密切相关.下列说法正确的是( )| A. | 干冰只能用于人工降雨 | |
| B. | Al(OH)3可以治疗胃酸过多,因此可大量使用 | |
| C. | 为了增强去污效果,在洗衣粉中添加三聚磷酸钠(Na5P3O10) | |
| D. | 侯氏制碱法不涉及基本反应类型中的置换反应 |
分析 A.依据干冰用途解答;
B.人体摄入过多量铝对人体有害;
C.含磷洗衣粉的使用能够引起水体的富营养化;
D.依据方程式NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl及置换反应概念判断.
解答 解:A.干冰的使用范围广泛,在食品、卫生、工业、餐饮中有大量应用,故A错误;
B.Al(OH)3可以治疗胃酸过多,但是不能大量使用,铝元素摄入过多对人体有害,故B错误;
C.三聚磷酸钠会使水体中磷元素过剩,引起水体富营养化,造成水体污染,故C错误;
D.置换反应为一种单质与一种化合物生成另一种单质和另一种化合物,NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl是复分解反应,不是置换反应,故D正确;
故选:D.
点评 本题考查了元素化合物知识、反应类型判断,明确相关物质的性质及用途,熟悉侯氏制碱法原理是解题关键,题目难度不大.

练习册系列答案
相关题目
9.现有FeO、Fe2O3、Fe3O4组成的混合物mg,向其中加入l00mL2mol/L硫酸,恰好完全溶解,若mg该混合物在过量CO气流中加热充分反应,则冷却后剩余固体的质量为( )
| A. | (m-1.6)g | B. | (m-2.4)g | C. | (m-3.2)g | D. | 无法计算 |
10.在无色强酸性溶液中,下列各组离子能大量共存的是( )
| A. | K+、Fe3+、SO42-、NO3- | B. | Na+、K+、NH4+、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | K+、Na+、ClO-、CO32- |
7.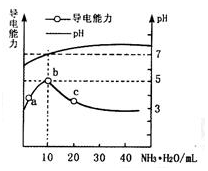 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | B. | b点溶液pH=7,此时酸碱恰好中和 | ||
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | D. | b、c两点水的电离程度:b<c |
14.下列有关试剂的保存方法错误的是( )
| A. | 氢氧化钠溶液保存在具有玻璃塞的试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 浓硝酸保存在棕色玻璃试剂瓶中 |
4.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 向Mg(OH)2悬浊液中滴加CuSO4溶液,生成蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小,Mg(OH)2转化为Cu(OH)2 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应会损失钾肥 |
| A. | A | B. | B | C. | C | D. | D |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.01mol•L-1氯水中,Cl2、Cl-和ClO-三粒子数目之和大于0.01NA | |
| B. | 氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目2NA | |
| C. | 0.1molCu与足量的浓硫酸完全反应后,溶液中Cu2+数目为0.1NA | |
| D. | 2.0g D2O中含有的质子数、电子数均为NA |
3.某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体.
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性.
请写出Ca在空气中燃烧发生反应的化学方程式:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C.
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:2CaO2+2H2O═2Ca(OH)2+O2↑ Ca3N2+6H2O═3Ca(OH)2+2NH3↑.
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2).臭氧还原为氧气.反应式为:O3+2KI+H2O=O2+I2+2KOH【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有O3;
假设3:该臭味气体含有NH3和O3.
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验.请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选).
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水.设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论.
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性.
请写出Ca在空气中燃烧发生反应的化学方程式:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C.
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:2CaO2+2H2O═2Ca(OH)2+O2↑ Ca3N2+6H2O═3Ca(OH)2+2NH3↑.
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2).臭氧还原为氧气.反应式为:O3+2KI+H2O=O2+I2+2KOH【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有O3;
假设3:该臭味气体含有NH3和O3.
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验.请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选).
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水.设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论.
| 实验操作 | 预期现象和结论 |
| 取少量反应后固体于试管中,向试管中加入少量水, 将湿润的红色石蕊试纸置于试管口; 另取少量反应后固体于试管中,向试管中加入少量水, 将产生气体通入淀粉-KI溶液中. |
4.设NA表示阿伏加德罗常数,下列关于0.2mol•L-1的BaCl2溶液中说法不正确的是( )
| A. | 2 L溶液中Ba2+和Cl-的总数为0.8NA | |
| B. | 500 mL溶液中Cl-的浓度为0.2 mol•L-1 | |
| C. | 500 mL溶液中Ba2+的浓度为0.2 mol•L-1 | |
| D. | 500 mL溶液中Cl-的总数为0.2NA |