题目内容
3.欲使 转变为
转变为 ,应用的试剂是( )
,应用的试剂是( )| A. | 盐酸 | B. | CO2 | C. | NaHCO3溶液 | D. | NaOH溶液 |
分析 已知酸性-COOH>H2CO3>酚-OH,则使 转变为
转变为 ,应加入酸性比-COOH的酸,以此解答该题.
,应加入酸性比-COOH的酸,以此解答该题.
解答 解:已知酸性-COOH>H2CO3>酚-OH,则使 转变为
转变为 ,应加入酸性比-COOH的酸,只有A符合.
,应加入酸性比-COOH的酸,只有A符合.
故选A.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握官能团的性质,本题注意酸性的强弱,难度不大.

练习册系列答案
相关题目
13.下列仪器称为“干燥管”的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列有关试剂的保存方法错误的是( )
| A. | 氢氧化钠溶液保存在具有玻璃塞的试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 浓硝酸保存在棕色玻璃试剂瓶中 |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.01mol•L-1氯水中,Cl2、Cl-和ClO-三粒子数目之和大于0.01NA | |
| B. | 氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目2NA | |
| C. | 0.1molCu与足量的浓硫酸完全反应后,溶液中Cu2+数目为0.1NA | |
| D. | 2.0g D2O中含有的质子数、电子数均为NA |
18.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 13g 和 和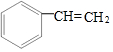 的混合物中含有的电子数为7NA 的混合物中含有的电子数为7NA | |
| B. | 60gSiO2中含有的共价键数目为4NA | |
| C. | 标准状况下,11.2LH2和Cl2反应后得到的气体中含有的原子总数为NA | |
| D. | 1molNaCO3溶于水后,所得溶液中CO32-和HCO3-的总数为NA |
3.某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体.
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性.
请写出Ca在空气中燃烧发生反应的化学方程式:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C.
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:2CaO2+2H2O═2Ca(OH)2+O2↑ Ca3N2+6H2O═3Ca(OH)2+2NH3↑.
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2).臭氧还原为氧气.反应式为:O3+2KI+H2O=O2+I2+2KOH【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有O3;
假设3:该臭味气体含有NH3和O3.
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验.请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选).
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水.设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论.
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性.
请写出Ca在空气中燃烧发生反应的化学方程式:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C.
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:2CaO2+2H2O═2Ca(OH)2+O2↑ Ca3N2+6H2O═3Ca(OH)2+2NH3↑.
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2).臭氧还原为氧气.反应式为:O3+2KI+H2O=O2+I2+2KOH【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有O3;
假设3:该臭味气体含有NH3和O3.
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验.请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选).
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水.设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论.
| 实验操作 | 预期现象和结论 |
| 取少量反应后固体于试管中,向试管中加入少量水, 将湿润的红色石蕊试纸置于试管口; 另取少量反应后固体于试管中,向试管中加入少量水, 将产生气体通入淀粉-KI溶液中. |
10.我市中考实行网上阅卷,答题时必须用2B铅笔填涂答题卡,2B铅笔的主要成分是( )
| A. | 铅 | B. | 铅合金 | C. | 石墨 | D. | 木炭 |
8.下列有关实验安全问题的叙述中错误的是( )
| A. | 少量的浓硫酸沾到皮肤上时,直接用大量的水冲洗,再涂上稀的NaHCO3溶液 | |
| B. | 为防止试管破裂,加热固体时试管口一般要略低于试管底部 | |
| C. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 | |
| D. | 在盛放浓硫酸的试剂瓶的标签上应印有的警示标记是 |