题目内容
18.下列关于${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl说法正确的是( )| A. | 具有相同的质子数 | B. | 具有相同的中子数 | ||
| C. | 具有相同的质量数 | D. | 它们不互为同位素 |
分析 A.原子的质子数等于元素的原子序数;
B.根据中子数=质量数-质子数计算;
C.元素左上角数字为质量数;
D.具有相同质子数,不同的中子数的原子之间互为同位素.
解答 解:A.氯的原子序数为17,原子的质子数等于元素的原子序数,则${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl原子所含质子数都为17,故A正确;
B.${\;}_{17}^{35}$Cl原子所含中子数为35-17=18,${\;}_{17}^{37}$Cl原子所含中子数为37-17=20,具有不相同的中子数,故B错误;
C.${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl的质量数分别为35、37,具有不相同的质量数,故C错误;
D.${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl的中子数分别为18、20,因质子数相同,中子数不同,互为同位素,故D错误;
故选A.
点评 本题考查质量数、中子数和质子数之间的关系以及同位素,明确符号的意义以及相关概念是解答本题的关键,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
4.下列除杂方法正确的是(括号内为杂质)( )
| A. | SO2(HCl)通过饱和Na2SO3溶液 | |
| B. | Na2CO3溶液(NaHCO3)滴加足量BaCl2溶液 | |
| C. | H2(H2S)通过CuSO4溶液 | |
| D. | Na2SO4溶液(Na2SO3)滴加足量HCl溶液 |
9.现有FeO、Fe2O3、Fe3O4组成的混合物mg,向其中加入l00mL2mol/L硫酸,恰好完全溶解,若mg该混合物在过量CO气流中加热充分反应,则冷却后剩余固体的质量为( )
| A. | (m-1.6)g | B. | (m-2.4)g | C. | (m-3.2)g | D. | 无法计算 |
6.合理利用燃料,减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( )
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 通入大大过量的空气使燃料充分燃烧,从而达到充分利用热能的目的 | |
| C. | 燃料的化学能可以在不同的条件下转化为热能、电能被人类利用 | |
| D. | 甲烷是比较洁净的燃料,标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程 式可表示为 CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
13.下列仪器称为“干燥管”的是( )
| A. |  | B. |  | C. |  | D. |  |
3.设NA为阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 0.1molNaCl固体中含0.1NA个阳离子 | |
| B. | 22.4LCO2含有的原子数是3NA | |
| C. | 常温常压下,NA个H2质量为2g | |
| D. | 1molMg与足量O2反应,失去的电子数是2NA |
10.在无色强酸性溶液中,下列各组离子能大量共存的是( )
| A. | K+、Fe3+、SO42-、NO3- | B. | Na+、K+、NH4+、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | K+、Na+、ClO-、CO32- |
7.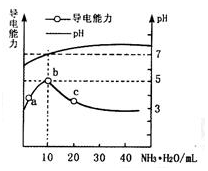 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | B. | b点溶液pH=7,此时酸碱恰好中和 | ||
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | D. | b、c两点水的电离程度:b<c |
3.某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体.
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性.
请写出Ca在空气中燃烧发生反应的化学方程式:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C.
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:2CaO2+2H2O═2Ca(OH)2+O2↑ Ca3N2+6H2O═3Ca(OH)2+2NH3↑.
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2).臭氧还原为氧气.反应式为:O3+2KI+H2O=O2+I2+2KOH【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有O3;
假设3:该臭味气体含有NH3和O3.
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验.请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选).
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水.设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论.
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性.
请写出Ca在空气中燃烧发生反应的化学方程式:Ca+O2$\frac{\underline{\;点燃\;}}{\;}$CaO2 3Ca+N2$\frac{\underline{\;点燃\;}}{\;}$Ca3N2 2Ca+CO2$\frac{\underline{\;点燃\;}}{\;}$2CaO+C.
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:2CaO2+2H2O═2Ca(OH)2+O2↑ Ca3N2+6H2O═3Ca(OH)2+2NH3↑.
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2).臭氧还原为氧气.反应式为:O3+2KI+H2O=O2+I2+2KOH【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有O3;
假设3:该臭味气体含有NH3和O3.
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验.请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选).
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水.设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论.
| 实验操作 | 预期现象和结论 |
| 取少量反应后固体于试管中,向试管中加入少量水, 将湿润的红色石蕊试纸置于试管口; 另取少量反应后固体于试管中,向试管中加入少量水, 将产生气体通入淀粉-KI溶液中. |