题目内容
17.工业上合成氨的条件是:采用400~500℃的高温、采用30~50MPa的压强、加催化剂.分析 根据影响化学反应速率的因素:温度、浓度、压强、催化剂、接触面积;影响化学平衡移动的因素:温度、浓度、压强等知识结合实际工业生产来回答.
解答 解:工业上合成氨的生产中采用400~500℃的高温,原因之一是考虑催化剂的活性,其二是为了提高反应速率,缩短达到平衡的时间;采用30~50MPa的压强,是为了保证较高的反应速率和较高的产率以及设备的耐压程度来考虑的.故答案为:采用400~500℃的高温;采用30~50MPa的压强;加催化剂.
点评 本题考查学生影响化学反应速率、以及化学平衡移动的因素,结合工业合成氨知识来考查,使得化学和实际联系更密切,难度不大.

练习册系列答案
相关题目
8. 已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
 已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO的燃烧热为-566 kJ/mol |
5.一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:
2A(g)+B(s)?2D (g)△H<0,测得相关数据如下,分析可知下列说法不正确的是( )
| 实验I | 实验II | 实验III | |
| 反应温度/℃ | 800 | 800 | 850 |
| c( A)起始/mol•L-1 | 1 | 2 | 1 |
| c( A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 化学平衡常数实验III的小于实验I的 | |
| B. | 实验放出的热量关系为b>2a | |
| C. | 实验III 在30min达到平衡,用A表示此段时间的平均反应速率v (A)为0.005mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应已达平衡 |
2.Na2O2 和NO2都是中学化学常见的物质,某实验小组对他们之间的反应进行探究.
(1)小组同学对NO2 与Na2O2 的反应提出以下假设.
假设一:生成NaNO3,反应的化学方程式为2NO2+Na2O2═2NaNO3
假设二:生成NaNO2,反应的化学方程式为2NO2+Na2O2═2NaNO2+O2.
(2)小组同学在通风橱中制备并收集干燥的NO2 后进行如下实验:
①实验室常利用铜与浓硝酸反应制备NO2,反应的化学方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O.
②有同学根据实验1 中“气球变瘪”的现象推断假设一成立,你认为是否合理并简述理由:不能根据“气球变瘪”的现象推断假设一成立,理由是:根据方程式可以发现无论是按假设一还是假设二发生反应,体系的压强都要减小,都能观察到“气球变瘪”的现象.
(3)小组同学进一步对产物进行检验
查阅资料:
i.Na2O2 与水反应会生成H2O2;
ii.NO2-具有还原性,可用KMnO4 酸性溶液进行检验;
iii.含NO3-的溶液遇 FeSO4和浓硫酸生成棕色物质[Fe(NO)]2-
进行实验:
进行实验:
①实验2 的主要目的是排出溶液中H2O2对后续实验的干扰,请补全实验2 的操作向其中加入少量MnO2粉末,待不再产生气泡后,静置后取上层清液.
②根据实验3 的现象可得出结论“产物含”NO2-,该实验的现象是KMnO4溶液褪色.
③实验4 中进行步骤②的目的是通过和实验4步骤①进行对比,排除NO2-的存在对NO3-检验的干扰.
(4)该小组同学由以上全部实验可得出结论:Na2O2和NO2反应既能生成NaNO3也能生成NaNO2(或“假设一和假设二都成立”,或“Na2O2和NO2反应的产物中既含NO2-又含NO3-”).
(1)小组同学对NO2 与Na2O2 的反应提出以下假设.
假设一:生成NaNO3,反应的化学方程式为2NO2+Na2O2═2NaNO3
假设二:生成NaNO2,反应的化学方程式为2NO2+Na2O2═2NaNO2+O2.
(2)小组同学在通风橱中制备并收集干燥的NO2 后进行如下实验:
| 序号 | 操作步骤 | 现象 |
| 实验1 | 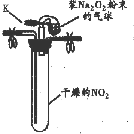 ①按如图组装仪器,打开K,将气球中的Na2O2粉末导入试管中,振荡,充分反应 | 试管内红棕色消失,气球变瘪 |
| ②试管冷却后,打开胶塞,加入5mL蒸馏水 | 未见红棕色气体,试管底部固体全部溶解得澄清溶液 |
②有同学根据实验1 中“气球变瘪”的现象推断假设一成立,你认为是否合理并简述理由:不能根据“气球变瘪”的现象推断假设一成立,理由是:根据方程式可以发现无论是按假设一还是假设二发生反应,体系的压强都要减小,都能观察到“气球变瘪”的现象.
(3)小组同学进一步对产物进行检验
查阅资料:
i.Na2O2 与水反应会生成H2O2;
ii.NO2-具有还原性,可用KMnO4 酸性溶液进行检验;
iii.含NO3-的溶液遇 FeSO4和浓硫酸生成棕色物质[Fe(NO)]2-
进行实验:
| 序号 | 操作步骤 | 现象 |
| 实验2 | 取实验1所得清液, 向其中加入少量MnO2粉末,待不再产生气泡后,静置后取上层清液,再调节此溶液pH至7左右 | / |
| 实验3 | 取实验2后的清液2mL,加入2滴0.1%的酸性KMnO4溶液 |
| 序号 | 操作步骤 | 现象 |
| 实验4 | ①向试管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO3溶液,振荡,再向试管中加入0.5mL98%的浓硫酸 | 滴入NaNO3溶液,无明显变化,加入浓硫酸后,溶液变棕色 |
| ②向试管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO2溶液,振荡,再向试管中加入0.5mL98%的浓硫酸 | 加入NaNO2溶液,立即变棕色,加入浓硫酸后,溶液无明显变化 | |
| ③向试管中加入2mL新制FeSO4溶液,再加入10滴实验2后的清液,振荡,再加0.5mL98%的浓硫酸 | 滴加实验2得到的清液后,溶液立即变浅棕色,加入浓硫酸后,溶液变深棕色 |
②根据实验3 的现象可得出结论“产物含”NO2-,该实验的现象是KMnO4溶液褪色.
③实验4 中进行步骤②的目的是通过和实验4步骤①进行对比,排除NO2-的存在对NO3-检验的干扰.
(4)该小组同学由以上全部实验可得出结论:Na2O2和NO2反应既能生成NaNO3也能生成NaNO2(或“假设一和假设二都成立”,或“Na2O2和NO2反应的产物中既含NO2-又含NO3-”).
9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
| A. | 甲的摩尔体积比乙的摩尔体积小 | |
| B. | 甲的物质的量比乙的物质的量多 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的分子数比乙的分子数少 |
6.下列说法正确的是( )
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 化学反应中的能量变化都是以热量的形式体现 | |
| D. | 2CO(g)+O2(g)═2CO2(g)△H<0,则56g CO和32g O2所具有的总能量小于88g CO2所具有的总能量 |
7.下列实验设计和结论正确的是( )
| A. | 采用加热蒸干高锰酸钾溶液的方法获得高锰酸钾晶体 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在漏斗内搅拌 | |
| C. | 用冷却结晶法提纯含有少量氯化钠杂质的硝酸钾固体 | |
| D. | 某无色溶液中加入稀盐酸无现象,再加Ba(NO3)2溶液,产生白色沉淀,则原溶液中一定有SO42- |
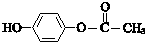
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$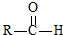 +H2O
+H2O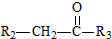 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$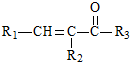 +H2O
+H2O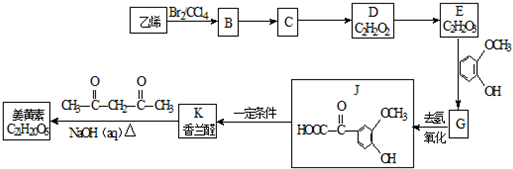
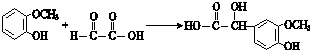 .
.
 .
.