题目内容
7.碳酸镁水合物是制备镁产品的中间体.工业上从弱碱性卤水(主要成份为MgCl2)中获取MgCO3•3H2O的方法如下(如图1):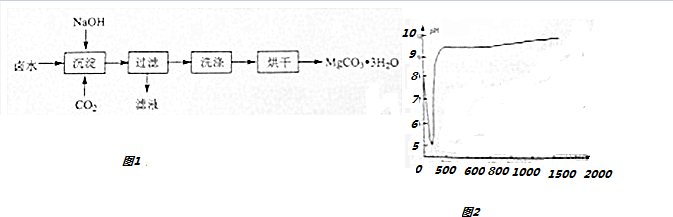
(1)写出沉淀过程的离子方程式Mg2++CO2+2OH-+2H2O=MgCO3•3H2O↓.
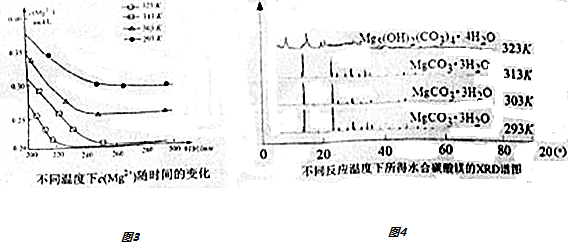
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为c(填序号)
a.向卤水中滴加NaOH溶液,
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
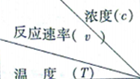
(3)沉淀过程中的c(Mg2+)随时间的变化如图3所示,不同温度下所得到的沉淀产物如图4所示.沉淀过程选择的温度为313K,理由是较高的温度能够加快沉淀反应的速率,也使得溶液中残留的c(Mg2+)较小,提高Mg2+的沉淀率,但温度过高易生成Mg5(OH)2(CO3)4•4H2O.
(4)写出MgCO3•3H2O在323K温度时发生转化的化学方程式5MgCO3•3H2O$\frac{\underline{\;加热\;}}{\;}$Mg5(OH)2(CO3)4•4H2O+CO2↑+10H2O.
(5)在洗涤步骤中,表明产物洗涤干净的操作为取最后一次洗涤滤液,向其中加入HNO3酸化的AgNO3溶液,若无白色沉淀生成,则已洗涤干净.
分析 从弱碱性卤水(主要成分为MgCl2)中获取MgCO3•3H2O,在卤水中加氢氧化钠并通入二氧化碳得碳酸镁晶体沉淀,经洗涤、烘干、得MgCO3•3H2O,
(1)沉淀过程中生成MgCO3•3H2O↓,根据电荷守恒和元素守恒书写反应的离子方程式;
(2)根据图1可知,沉淀过程的pH随时间的变化是先变小后增大,然后保持在9-10之间左右,而溶液起始的PH值在7-8左右,据此判断;
(3)根据图2可知,较高的温度能够加快沉淀反应的速率,也使得溶液中残留的c(Mg2+)较小,根据图3可知,323K时,Mg2+生成Mg5(OH)2(CO3)4•4H2O沉淀;
(4)MgCO3•3H2O在323K温度时转化成Mg5(OH)2(CO3)4•4H2O,根据元素守恒书写化学方程式;
(5)在洗涤步骤中,沉淀是从含有氯离子的溶液中析出的,所以可以通过检验氯离子判断产物洗涤是否干净.
解答 解:从弱碱性卤水(主要成分为MgCl2)中获取MgCO3•3H2O,在卤水中加氢氧化钠并通入二氧化碳得碳酸镁晶体沉淀,经洗涤、烘干、得MgCO3•3H2O,
(1)沉淀过程中生成MgCO3•3H2O↓,反应的离子方程式为Mg2++CO2+2OH-+2H2O═MgCO3•3H2O↓,
故答案为:Mg2++CO2+2OH-+2H2O═MgCO3•3H2O↓;
(2)根据图1可知,沉淀过程的pH随时间的变化是先变小后增大,然后保持在9-10之间左右,而溶液起始的PH值在7-8左右,所以沉淀过程的操作为向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2,
故选c;
(3)根据图2可知,较高的温度能够加快沉淀反应的速率,也使得溶液中残留的c(Mg2+)较小,根据图3可知,323K时,Mg2+生成Mg5(OH)2(CO3)4•4H2O沉淀,所以选择的温度为313K,理由是较高的温度能够加快沉淀反应的速率,也使得溶液中残留的c(Mg2+)较小,提高Mg2+的沉淀率,但温度过高易生成Mg5(OH)2(CO3)4•4H2O,
故答案为:313K;较高的温度能够加快沉淀反应的速率,也使得溶液中残留的c(Mg2+)较小,提高Mg2+的沉淀率,但温度过高易生成Mg5(OH)2(CO3)4•4H2O;
(4)MgCO3•3H2O在323K温度时转化成Mg5(OH)2(CO3)4•4H2O,反应的化学方程式为5MgCO3•3H2O$\frac{\underline{\;加热\;}}{\;}$Mg5(OH)2(CO3)4•4H2O+CO2↑+10H2O,
故答案为:5MgCO3•3H2O$\frac{\underline{\;加热\;}}{\;}$Mg5(OH)2(CO3)4•4H2O+CO2↑+10H2O;
(5)在洗涤步骤中,沉淀是从含有氯离子的溶液中析出的,所以可以通过检验氯离子判断产物洗涤是否干净,所以表明产物洗涤干净的操作为取最后一次洗涤滤液,向其中加入HNO3酸化的AgNO3溶液,若无白色沉淀生成,则已洗涤干净,
故答案为:取最后一次洗涤滤液,向其中加入HNO3酸化的AgNO3溶液,若无白色沉淀生成,则已洗涤干净.
点评 本题考查制备实验方案的设计,为高考考点,准确理解工业原理、掌握实验基本操作为解答的关键,侧重分析与实验能力的考查,题目难度中等.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| A. | Cu | B. | K2SO4 | C. | MgCl2溶液 | D. | 盐酸 |
【猜想】猜想1:可以减少汽车尾气的污染;
猜想2:可以产生更多的热量,增强汽车的动力.
【设计与实验】
| 序号 | 实验步骤 | 实验现象 | 结论 |
| Ⅰ | 在两个蒸发皿中各加入10mL冷水,控制相同燃烧条件,分别用乙醇和汽油作为燃料进行加热,记录从开始到水沸腾的时间. | 用乙醇加热耗时118s;用汽油加热耗时56s. | 猜想2不成立 (填“成立”或“不成立”) |
| Ⅱ | 实验Ⅰ停止加热后,取下蒸发皿,观察蒸发皿的底部. | 用乙醇加热的蒸发皿底部只有及少量炭黑,而用汽油加热的蒸发皿底部有大量的炭黑. | 猜想1成立(可仿照上格填写) |
(1)实验Ⅰ是一个对比实验,实验过程中不一定控制的条件是B(填序号);
A.水的初始温度必须相同 B.加热开始计时点必须相同
C.燃具产生火焰的大小必须相同 D.蒸发皿的大小必须相同
(2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将减少;
(3)目前乙醇汽油中乙醇的添加量约为10%,可一定程度节省石油资源.结合实验Ⅰ的结论分析,如果乙醇的添加量过大,会使汽车动力减弱(填“增强”“减弱”“不变”).
 | 1.200 | 1.000 | 0.800 | 0.600 |
| 270 | 3.60 | 3.00 | 2.40 | 1.80 |
| 280 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | 升高温度或增大A的浓度都可以增大v的值 | |
| B. | 同时改变反应温度和A的浓度,v可能不变 | |
| C. | a=6.00 | |
| D. | 270<b<280 |

 如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答: