题目内容
7.下列实验设计和结论正确的是( )| A. | 采用加热蒸干高锰酸钾溶液的方法获得高锰酸钾晶体 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在漏斗内搅拌 | |
| C. | 用冷却结晶法提纯含有少量氯化钠杂质的硝酸钾固体 | |
| D. | 某无色溶液中加入稀盐酸无现象,再加Ba(NO3)2溶液,产生白色沉淀,则原溶液中一定有SO42- |
分析 A.加热蒸干高锰酸钾溶液,高锰酸钾分解;
B.玻璃棒在漏斗内搅拌,易捣破滤纸;
C.二者溶解度受温度影响不同;
D.检验硫酸根离子,使用氯化钡.
解答 解:A.加热蒸干高锰酸钾溶液,高锰酸钾分解,应冷却结晶获得高锰酸钾晶体,故A错误;
B.玻璃棒在漏斗内搅拌,易捣破滤纸,则过滤时不能搅拌,故B错误;
C.二者溶解度受温度影响不同,则用冷却结晶法提纯含有少量氯化钠杂质的硝酸钾固体,故C正确;
D.检验硫酸根离子,使用氯化钡,酸性条件下亚硫酸根离子与硝酸根离子可发生氧化还原反应,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、离子检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
18.下列反应属于离子反应的是( )
| A. | 实验室选用高锰酸钾制取氧气 | B. | 氢气在氧气中燃烧生成水 | ||
| C. | 煅烧石灰石制取生石灰 | D. | 用锌粒和盐酸制取氢气 |
15.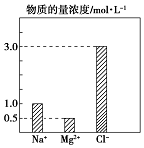 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:
(1)实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、洗涤、灼烧、在干燥器中冷却.
(2)原溶液中H+物质的量浓度为1.2mol/L.
(3)向溶液中加入NaHCO3溶液,反应的离子方程式为:H++HCO3-=H2O+CO2↑.
(4)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时加入的Ba(OH)2溶液体积为0.1 L.
 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 仔细观察坐标图 | 肯定无 CO32- | 肯定无该离子的理由碳酸根离子和镁离子之间会反应 |
| 步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 Fe3+ | 肯定无该离子的理由该离子为黄色 |
| 步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42-、H+;肯定无Ba2+ | 肯定有H+的理由电荷守恒 |
(2)原溶液中H+物质的量浓度为1.2mol/L.
(3)向溶液中加入NaHCO3溶液,反应的离子方程式为:H++HCO3-=H2O+CO2↑.
(4)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时加入的Ba(OH)2溶液体积为0.1 L.
19.下列药品,在空气中既不易被氧化,也不易分解,且可以用无色玻璃瓶存放的是( )
| A. | 氯水 | B. | 钠 | C. | 浓硝酸 | D. | 浓盐酸 |
 某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.
某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.