题目内容
9.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 标准状况下,11.2L溴单质含有NA个溴原子 | |
| C. | 常温常压下,28g乙烯和丙烯的混合气体含有的原子总数为6NA | |
| D. | 1mol乙醇与1mol乙酸混合充分反应后生成乙酸乙酯分子数为NA |
分析 A.气体摩尔体积使用对象为气体;
B.标况下溴为液体;
C.根据乙烯和丙烯的最简式计算出28g混合气体中含有的原子数目;
D.酯化反应为可逆反应.
解答 解:A.标况下辛烷为液体,不能使用气体摩尔体积,故A错误;
B.标况下溴为液体,不能使用气体摩尔体积,故B错误;
C.乙烯和丙烯的最简式为CH2,28g混合气体中含有最简式CH2的物质的量为2mol,含有原子总数为2mol×3×NA=6NA,故C正确;
D.酯化反应为可逆反应,1mol乙醇与1mol乙酸混合充分反应后生成乙酸乙酯分子数小于NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意是否在标准状况下及标况下物质的状态情况,注意烯烃的结构特点,注意酯化反应为可逆反应题目难度不大.

练习册系列答案
相关题目
17.在基态多电子原子中,关于核外电子能量的叙述错误的是( )
| A. | 同一能层的px、py、pz轨道电子能量相同 | |
| B. | 3d3表示3d能级有3个轨道 | |
| C. | p轨道电子能量不一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
4.现拟在实验室里利用空气和镁粉为原料,制取少量纯净的氮化镁(Mg3N2).已知实验中加热条件下可能发生的以下反应:
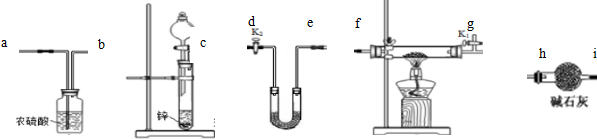
可供选择的装置和药品如图所示(镁粉和还原铁粉均已干燥,装置内所发生的反应都是完全的,整套装置的末端与干燥管相连接),请回答下列问题: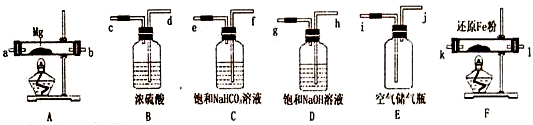
(1)为了实现实验目的,在设汁实验方案时,除装置A、E、F外,还应选择的装置有B、D(填字母代号);选择装置F的目的是为了除去空气中的氧气.
(2)连接并检査装置的气密性.实验开始时,打开自来水的开关,将空气从储气瓶压入反应装置,则气流流经导管的顺序是j→h→g→d→c→k→l(或l→k)→a→b(或b→a)(填字母代号).
(3)通入气体后,如果同时点燃A、F装置的酒精灯,对实验结果中所得产品的质量比理论值大 (填“大“或“小”),其一原因是同时点燃酒精灯,A中硬质玻璃管中的空气没有排净,其中的氧气、少量二氧化碳和水蒸气与镁反应,生成了氧化镁.另一原因是由于镁全部本该生成氮化镁,装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧气与装置A中的镁粉反应,使部分镁生成了氧化镁.
(4)请设计一个实验,验证产物是氮化镁:取适量产物放入试卷中,滴加蒸馏水,将湿润的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成.
| 反应物 | 生成物 | 反应物 | 生成物 |
| 镁和氧气 | 氧化镁 | 镁和水 | 氧化镁和氢气 |
| 镁和氮气 | 氮化镁 | 氮化镁和水 | 氢氧化镁和氨气 |
| 镁和二氧化碳 | 氧化镁和碳 |

(1)为了实现实验目的,在设汁实验方案时,除装置A、E、F外,还应选择的装置有B、D(填字母代号);选择装置F的目的是为了除去空气中的氧气.
(2)连接并检査装置的气密性.实验开始时,打开自来水的开关,将空气从储气瓶压入反应装置,则气流流经导管的顺序是j→h→g→d→c→k→l(或l→k)→a→b(或b→a)(填字母代号).
(3)通入气体后,如果同时点燃A、F装置的酒精灯,对实验结果中所得产品的质量比理论值大 (填“大“或“小”),其一原因是同时点燃酒精灯,A中硬质玻璃管中的空气没有排净,其中的氧气、少量二氧化碳和水蒸气与镁反应,生成了氧化镁.另一原因是由于镁全部本该生成氮化镁,装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧气与装置A中的镁粉反应,使部分镁生成了氧化镁.
(4)请设计一个实验,验证产物是氮化镁:取适量产物放入试卷中,滴加蒸馏水,将湿润的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成.
1.下列事故处理措施正确的是( )
| A. | 金属钠着火,立即用水灭火 | |
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 | |
| C. | 酒精灯不慎着火,应立即吹熄 | |
| D. | 眼睛里溅进盐酸,立即用 NaOH 溶液洗涤眼睛 |
18.在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:3A(气)+2B(气)?xC(气)+yD(气)达到平衡时,C的体积分数为m%.若维持温度、压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为( )
| A. | x=3 y=l | B. | x=4 y=1 | C. | x=5 y=1 | D. | x=2 y=3 |
19.下列物质是中学化学常见的碱,在相同条件下,碱性最强的是( )
| A. | Ca(OH)2 | B. | Mg(OH)2 | C. | KOH | D. | NaOH |
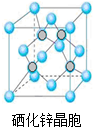 【化学-选修3物质结构与性质】
【化学-选修3物质结构与性质】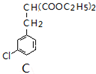 $\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$D$\stackrel{SOCl_{2}}{→}$
$\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$D$\stackrel{SOCl_{2}}{→}$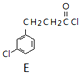 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$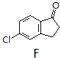
 或
或 (任写一种).
(任写一种). .
.