题目内容
19.下列物质是中学化学常见的碱,在相同条件下,碱性最强的是( )| A. | Ca(OH)2 | B. | Mg(OH)2 | C. | KOH | D. | NaOH |
分析 元素的金属性越强,其最高价氧化物的水化物碱性越强,据此分析解答.
解答 解:元素的金属性越强,其最高价氧化物的水化物碱性越强,这几种元素金属性强弱顺序是K>Ca>Na>Mg,则其最高价氧化物是水化物碱性最强的是KOH,故选C.
点评 本题考查碱性强弱判断,为高频考点,明确金属性与其最高价氧化物的水化物碱性强弱关系是解本题关键,知道金属性强弱判断方法,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
9.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 标准状况下,11.2L溴单质含有NA个溴原子 | |
| C. | 常温常压下,28g乙烯和丙烯的混合气体含有的原子总数为6NA | |
| D. | 1mol乙醇与1mol乙酸混合充分反应后生成乙酸乙酯分子数为NA |
14.化学与生产、生活、社会密切相关.下列说法不正确的是( )
| A. | 工厂中常用的静电除尘装置是根据胶体粒子的带电性而设计的 | |
| B. | 过氧化钠(Na2O2)常用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 波尔多液(CuSO4)常用来配制农药,主要因为Cu2+具有氧化性 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化,主要是因为胶体的吸附性 |
4.下列有关化学用语表示正确的是( )
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: | |
| C. | 四氯化碳的电子式: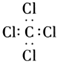 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
11.高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面.
查阅资料得到以下有关高氯酸的信息:
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如图:

(1)操作①的名称是过滤.
(2)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的为了产物能得到HClO4而不是NaClO4.
(3)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(4)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4.
(5)若想得到201kg的 HClO4纯品,至少需要NaClO3639kg.
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)4H2O+HCl-8e-=HClO4+8H+.
查阅资料得到以下有关高氯酸的信息:
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |

(1)操作①的名称是过滤.
(2)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的为了产物能得到HClO4而不是NaClO4.
(3)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(4)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4.
(5)若想得到201kg的 HClO4纯品,至少需要NaClO3639kg.
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)4H2O+HCl-8e-=HClO4+8H+.
8.下列属于等电子体的是 ( )
| A. | N2O和CO2 | B. | O3和NO2 | C. | CH4和NH3 | D. | OH-和NH2 |