题目内容
下列实验不能达到目的是( )
| A、向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 |
| B、向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 |
| C、将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 |
| D、将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.Na2SiO3溶液因水解显碱性;
B.发生氧化还原反应生成硫酸,不能比较酸性的强弱;
C.铝与氧气反应生成氧化铝的熔点高;
D.氯水有强氧化性,能将石蕊氧化.
B.发生氧化还原反应生成硫酸,不能比较酸性的强弱;
C.铝与氧气反应生成氧化铝的熔点高;
D.氯水有强氧化性,能将石蕊氧化.
解答:
解:A.Na2SiO3溶液因水解显碱性,不水解的话呈中性,故A正确;
B.发生氧化还原反应生成硫酸,不能比较酸性的强弱,不发生强酸制取弱酸的反应,事实上硫酸为强酸、HClO为弱酸,故B错误;
C.铝与氧气反应生成氧化铝的熔点高,则铝箔在酒精灯火焰上加热熔化但不滴落,故C正确;
D.氯水有强氧化性,能将石蕊氧化,证明氯水具有漂白性,故D正确.
故选B.
B.发生氧化还原反应生成硫酸,不能比较酸性的强弱,不发生强酸制取弱酸的反应,事实上硫酸为强酸、HClO为弱酸,故B错误;
C.铝与氧气反应生成氧化铝的熔点高,则铝箔在酒精灯火焰上加热熔化但不滴落,故C正确;
D.氯水有强氧化性,能将石蕊氧化,证明氯水具有漂白性,故D正确.
故选B.
点评:本题考查化学实验方案的评价,涉及氧化还原反应、酸性比较、氯水和铝的化学性质等,注重物质性质及物质分类的考查,综合性较强,但题目难度不大.

练习册系列答案
相关题目
下列溶液中各微粒的浓度关系不正确的是( )
| A、0.1mol/L的 NaHCO3溶液中:c (Na+)+c (H+)+C(H2CO3)=c (HCO3-)+c(CO32-)+c (OH-) |
| B、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>C(HX)>C(X-)>C(H+)>C(OH-) |
| C、在纯碱溶液中存在:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3) |
| D、0.1mol/L HCOOH溶液中:C(HCOO-)+C(OH-)=C(H+) |
甲醛(CH2O)、乙酸(C2H4O2)、和丙酸(C3H6O2)组成的混合物中,氧元素的质量分数为44%,则碳元素的质量分数为( )
| A、44% | B、48% |
| C、56% | D、无法计算 |
一定温度下,氯化银在水中存在溶解平衡 AgCl(s)?Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中.搅拌后在相同的温度下Ag+浓度由大到小的顺序是( )
| A、③>①>②>④ |
| B、②>①>④>③ |
| C、④>③>②>① |
| D、①>③>④>② |
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向2L正庚烷中加入(t-BuNO)2 1.0mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2L).下列说法正确的是( )
| A、反应在前10min内的平均速率为ν(t-BuNO)=0.0375mol?L-1?min-1 |
| B、保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
C、保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用图表示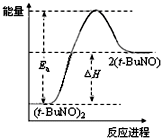 |
| D、保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
通过NOx传感器可监测NOx的含量,其工作原理示意图如图,下列说法正确的是( )


| A、NiO电极是该电池的正极 |
| B、Pt电极附近的pH增大 |
| C、NiO电极的电极反应式:NO-2e-+O2-═NO2 |
| D、固体电解质中O2-向正极移动 |
 2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.
 右图是铜与稀硝酸反应的实验装置图,请回答下列问题:
右图是铜与稀硝酸反应的实验装置图,请回答下列问题: