题目内容
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向2L正庚烷中加入(t-BuNO)2 1.0mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2L).下列说法正确的是( )
| A、反应在前10min内的平均速率为ν(t-BuNO)=0.0375mol?L-1?min-1 |
| B、保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
C、保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用图表示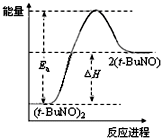 |
| D、保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是75%,
则(t-BuNO)2?2(t-BuNO)
开始 0.5 0
转化0.5×75% 0.5×75%×2
平衡0.5×(1-75%) 0.5×75%×2
K=
=4.5(mol/L);
以此解答该题.
则(t-BuNO)2?2(t-BuNO)
开始 0.5 0
转化0.5×75% 0.5×75%×2
平衡0.5×(1-75%) 0.5×75%×2
K=
| (0.5×75%×2)2 |
| 0.5×(1-75%) |
以此解答该题.
解答:
解:当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是75%,
则(t-BuNO)2?2(t-BuNO)
开始 0.5 0
转化0.5×75% 0.5×75%×2
平衡0.5×(1-75%) 0.5×75%×2
K=
=4.5(mol/L);
A.反应在前10 min内的平均速率为ν(t-BuNO)=
=0.075mol?L-1?min-1,故A错误;
B.若此时再向溶保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)的方向移动,平衡向正反应方向移动,故B错误;
C.保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,说明平衡向正反应方向移动,则正反应为吸热反应,反应物总能量小于生成物总能量,故C正确.
D.平衡时平衡常数为4.5,而此时为1.9,说明平衡向逆反应方向移动,则(t-BuNO)2的平衡转化率小于75%,故D错误;
故选C.
则(t-BuNO)2?2(t-BuNO)
开始 0.5 0
转化0.5×75% 0.5×75%×2
平衡0.5×(1-75%) 0.5×75%×2
K=
| (0.5×75%×2)2 |
| 0.5×(1-75%) |
A.反应在前10 min内的平均速率为ν(t-BuNO)=
| 0.5×75%×2mol/L |
| 10min |
B.若此时再向溶保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)的方向移动,平衡向正反应方向移动,故B错误;
C.保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,说明平衡向正反应方向移动,则正反应为吸热反应,反应物总能量小于生成物总能量,故C正确.
D.平衡时平衡常数为4.5,而此时为1.9,说明平衡向逆反应方向移动,则(t-BuNO)2的平衡转化率小于75%,故D错误;
故选C.
点评:本题考查学生利用化学平衡常数及化学平衡的三段法计算来分析解答,考查知识点较集中,注重对学生基础知识和技能的考查,并训练学生分析图象、画图象的能力.

练习册系列答案
相关题目
一定浓度l00mL的HNO3溶液中加入2.8g Fe,全部溶解,得到标准状况下的NO气体1.12L,测得反应后溶液中的c(H+)=0.1mol/L.若反应前后溶液体积变化忽略不计,则下列有关判断错误的是( )
| A、反应后溶液中无硝酸亚铁 |
| B、反应前HNO3溶液的浓度为2.0mol?L-1 |
| C、反应后溶液中c(NO3-)=1.6mol?L-1 |
| D、反应后的溶液最多还能溶解1.61g Fe |
下列实验不能达到目的是( )
| A、向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 |
| B、向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 |
| C、将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 |
| D、将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 |
常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,得到pH=9的混合溶液(溶质为NaCl与NaC1O).下列说法正确的是(NA代表阿伏伽德罗常数)( )
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右下图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右下图所示装置.试回答下列问题:
 甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.
甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.