题目内容
 2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.汽车尾气净化的主要原理为:2NO(g)+2CO(g)
| 催化剂 |
(1)该反应为
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在答题卡上画出 c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
(3)某科研机构,在t1℃下,体积恒定的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度(具体数据见下表,CO2和N2的起始浓度为0).
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是

(下图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(5)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)=N2 (g)+CO2 (g)+2H2O(g)△H=-867.0kJ?mol-1
2NO2 (g)═N2O4 (g)△H=-56.9kJ?mol-1
H2O(g)=H2O(l)△H=-44.0kJ?mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式
考点:反应速率的定量表示方法,用盖斯定律进行有关反应热的计算,化学平衡常数的含义,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)①根据到达平衡的时间判断温度高低,根据平衡时二氧化碳的浓度判断温度对平衡的影响,进而判断△H;
由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=
计算v(CO2),再根据速率之比等于化学计量数之比计算v(N2);
(2)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,
平衡时二氧化碳的浓度与温度T1到达平衡时相同;
(3)依据平衡常数概念是利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积,代入平衡浓度即可计算出平衡常数,NO的平衡浓度与平衡总浓度之比为NO的体积分数;
(4)A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D、到达平衡后各组分的含量不发生变化;
(5)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式.
由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=
| △c |
| △t |
(2)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,
平衡时二氧化碳的浓度与温度T1到达平衡时相同;
(3)依据平衡常数概念是利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积,代入平衡浓度即可计算出平衡常数,NO的平衡浓度与平衡总浓度之比为NO的体积分数;
(4)A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D、到达平衡后各组分的含量不发生变化;
(5)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式.
解答:
解:(1)①由图1可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,
故答案为:放热;
②由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=
=0.05mol/(L?s),
速率之比等于化学计量数之比,故v(N2)=
v(CO2)=
×0.05mol/(L?s)=0.025mol/(L?s),
故答案为:0.025mol/(L?s);
(2)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,
但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为: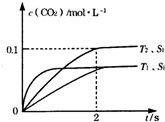 ,
,
故答案为: ;
;
(3)NO和CO反应生成CO2和N2,反应方程式为:
2NO+2CO?2CO2 +N2
起始浓度:1xl0-3 3.6xl0-3 0 0
转化浓度:0.9xl0-3 0.9xl0-3 0.9xl0-3 0.45xl0-3
平衡浓度:0.1xl0-3 2.7xl0-3 0.9xl0-3 0.45xl0-3
反应的平衡常数K=
,代入平衡浓度得:K=5000,
NO的体积分数为:
×100%=2.41%,
故答案为:5000 2.41%;
(4)A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,
为最小,图象与实际符合,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:B D;
(5)已知:①CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
②2NO2(g)?N2O4(g)△H2=-56.9kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
根据盖斯定律,①-②+③×2得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),
故△H=-867kJ/mol-(-56.9kJ/mol)-44.0kJ?mol-1×2=-898.1kJ/mol,
即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(l)△H═-898.1kJ/mol
故答案为:放热;
②由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=
| 0.1mol/L |
| 2S |
速率之比等于化学计量数之比,故v(N2)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.025mol/(L?s);
(2)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,
但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为:
 ,
,故答案为:
 ;
;(3)NO和CO反应生成CO2和N2,反应方程式为:
2NO+2CO?2CO2 +N2
起始浓度:1xl0-3 3.6xl0-3 0 0
转化浓度:0.9xl0-3 0.9xl0-3 0.9xl0-3 0.45xl0-3
平衡浓度:0.1xl0-3 2.7xl0-3 0.9xl0-3 0.45xl0-3
反应的平衡常数K=
| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
NO的体积分数为:
| 0.1 |
| 0.1+2.7+0.9+0.45 |
故答案为:5000 2.41%;
(4)A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,
为最小,图象与实际符合,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:B D;
(5)已知:①CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
②2NO2(g)?N2O4(g)△H2=-56.9kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ?mol-1
根据盖斯定律,①-②+③×2得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),
故△H=-867kJ/mol-(-56.9kJ/mol)-44.0kJ?mol-1×2=-898.1kJ/mol,
即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(l)△H═-898.1kJ/mol
点评:本题考查化学平衡图象、化学反应速率、影响化学平衡的因素、平衡常数计算、热化学方程式书写等,题目综合性较大,较难,是对知识的综合利用、注意基础知识的理解掌握.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
 O3可通过臭氧发生器电解稀硫酸制得(原理如图).下列有关说法不正确的是( )
O3可通过臭氧发生器电解稀硫酸制得(原理如图).下列有关说法不正确的是( )| A、电极A为阴极 |
| B、质子由A极通过交换膜移向B极 |
| C、若C极通入O2,则A的电极反应式为O2+4e-+4H+═2H2O |
| D、若C处不通入O2,D、E处分别收集到15.68L和6.72L气体(标准状况),则E处收集的气体中O2和O3的体积比为2:1(忽略O3的分解) |
下列叙述中,正确的是(NA代表阿伏加德罗常数)( )
| A、标准状况下,22.4 L水所含的水分子数为NA |
| B、1 mol?L-1FeCl3溶液中所含Cl-的数目为3NA |
| C、25℃,1.01×105Pa,14g氮气所含的氮原子数为NA |
| D、1 mol Na2SO4溶于水,所得溶液中Na+的数目为NA |
下列实验不能达到目的是( )
| A、向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 |
| B、向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 |
| C、将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 |
| D、将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 |
如图为一原电池的结构示意图,下列说法中,不正确的是( )


| A、原电池工作时的总反应为Zn+Cu2+=Zn2++Cu |
| B、原电池工作时,Zn电极流出电子,发生氧化反应 |
| C、原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深 |
| D、盐桥中阳离子流向CuSO4溶液中 |
氢氟酸(HF)是一种弱酸.25℃时,向20mLO.1mol?L-1氢氟酸中加入VmL0.1mol?L-1NaOH溶液充分反应.已知:HF(aq)+OH-(aq)═F-(aq)+H2O(1)△H=-67.7kJ?mol-1,H+(aq)+OH-(aq)═H2O(1)△H═-57.3
kJ?mol- 根据题意,下列判断或结论正确的是( )
kJ?mol- 根据题意,下列判断或结论正确的是( )
| A、氢氟酸的电离过程是吸热的 |
| B、当V=20时,溶液中:c(F-)<c(Na+)=0.1mol?L-1 |
| C、当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) |
| D、当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+) |

