题目内容
13.三种弱酸HA、H2B、HC,电离常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA+HB-(少量)═A-+H2B
②H2B(少量)+C-═HB-+HC
③HA(少量)+C-═A-+HC
则三种酸对应的电离常数分别为(请填空)
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka | |
| 数值 | 1.8×10-5 | 4.3×10-7 | ||
分析 酸性强的酸能制备酸性弱的酸,酸性越强,其电离常数越大,据此分析.
解答 解:①HA+HB-(少量)═A-+H2B,酸性:HA>H2B;
②H2B(少量)+C-═HB-+HC,酸性:H2B>HC>HB-;
③HA(少量)+C-═A-+HC,酸性:HA>HC;
综上可知,酸性:HA>H2B>HC>HB-,酸性越强,弱酸的电离平衡常数越大,所以HC的Ka为4.9×10-10,H2B的Ka2为5.6×10-11;
故答案为:
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka | |
| 数值 | 1.8×10-5 | 4.3×10-7 | 5.6×10-11 | 4.9×10-10 |
点评 本题考查了弱电解质的电离平衡常数、强酸制弱酸原理,题目难度不大,明确弱酸的电离平衡常数与酸性强弱的关系即可解答,侧重于考查学生对基本原理的理解和应用能力.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.下表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键名称).
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子内层电子数是其最外层电子数的三分之一 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键名称).
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式SO32-+ClO-═SO42-+Cl-.
1.解释下列事实的方程式正确的是( )
| A. | 淀粉碘化钾在空气中变蓝:2I-+O2+4H+═2H2O+I2 | |
| B. | Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32-+Ca2+=CaCO3↓ | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2=2CO2+2CaSO4 |
8.某无色溶液能与铝作用放出H2,则下列离子组合中可能的是( )
| A. | H+、Cl-、Fe2+、Ba2+ | B. | OH-、NO3-、Ba2+、Cl- | ||
| C. | H+、CO32-、Mg2+、Ba2+ | D. | OH-、NO3-、CO32-、Mg2+ |
18.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.2mol Cu(OH)2后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解),则电解过程中转移电子的物质的量为( )
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
2.下列说法正确的是( )
| A. | ${\;}_{\;}^{16}{O}_{2}$、${\;}_{\;}^{18}{O}_{2}$互为同位素 | B. | H2O、D2O、T2O的化学性质不同 | ||
| C. | 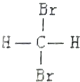 和 和 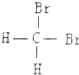 是两种不同结构 是两种不同结构 | D. | 白磷与红磷互为同素异形体 |
3.下列说法错误的是( )
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1.0 mol•L-1Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
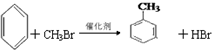 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.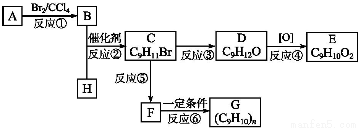
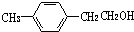 ,F的分子式C9H10.
,F的分子式C9H10.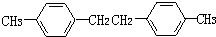 .
.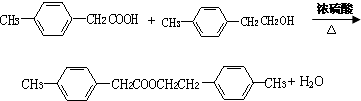 .
.