题目内容
8.某无色溶液能与铝作用放出H2,则下列离子组合中可能的是( )| A. | H+、Cl-、Fe2+、Ba2+ | B. | OH-、NO3-、Ba2+、Cl- | ||
| C. | H+、CO32-、Mg2+、Ba2+ | D. | OH-、NO3-、CO32-、Mg2+ |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;与铝作用放出H2,该溶液中存在大量氢离子或氢氧根离子,
A.亚铁离子为有色离子;
B.四种离子之间不反应,碱性溶液中能够共存;
C.氢离子、镁离子、钡离子都与碳酸根离子反应;
D.氢氧根离子、碳酸根离子都与镁离子反应.
解答 解:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;能与铝作用放出H2,该溶液中存在大量氢离子或氢氧根离子,
A.Fe2+为有色离子,在溶液中不能大量存在,故A错误;
B.OH-、NO3-、Ba2+、Cl-之间不发生反应,在碱性溶液中能够大量共存,故B正确;
C.H+、Mg2+、Ba2+都与CO32-、发生反应,在溶液中不能大量共存,故C错误;
D.OH-、CO32-都与Mg2+反应,在溶液中一定不能大量共存,故C错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
18.下列物质的电子式书写正确的是( )
| A. | N2 | B. | Na2O  | C. | H2O  | D. | NH4I  |
16.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 钢铁发生电化学腐蚀时,负极反应为Fe-3e-=Fe3+ | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁制品中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
3.常见元素A、B、C、D、E的原子序数依次增大,其相关信息如表:
(1)E位于元素周期表的位置是第4周期第VIII族.
(2)C元素基态原子的电子排布图 .
.
(3)C单质分子的电子式为 ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个含4个原子的分子,乙分子的中心原子的杂化方式为sp杂化.已知13g乙完全燃烧放出的热量为600kj,则乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200kJ/mol.
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
(2)C元素基态原子的电子排布图
 .
.(3)C单质分子的电子式为
 ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个含4个原子的分子,乙分子的中心原子的杂化方式为sp杂化.已知13g乙完全燃烧放出的热量为600kj,则乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200kJ/mol.
13.三种弱酸HA、H2B、HC,电离常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)═A-+H2B
②H2B(少量)+C-═HB-+HC
③HA(少量)+C-═A-+HC
则三种酸对应的电离常数分别为(请填空)
①HA+HB-(少量)═A-+H2B
②H2B(少量)+C-═HB-+HC
③HA(少量)+C-═A-+HC
则三种酸对应的电离常数分别为(请填空)
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka | |
| 数值 | 1.8×10-5 | 4.3×10-7 | ||
20.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
上述盐溶液中的阴离子,结合氢离子能力最强的是;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填序号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:<(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:②>①
(3)碳酸氢钠是一种强(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的pH下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)3]Ksp[Mg(OH)2]<(填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为6.( Ksp[Cu(OH)2]=2×10-20 )
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:<(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:②>①
(3)碳酸氢钠是一种强(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的pH下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
17.下列说法正确的是( )
| A. | 六方最密堆积和面心立方最密堆积的原子堆积方式,空间利用率最高 | |
| B. | 分子晶体中,分子间作用力越大,分子越稳定 | |
| C. | 熔点:BaO>CaO>NaCl>KCl | |
| D. |  某晶体的晶胞如图所示,这种晶体中A、B、C三种粒子个数之比是1:2:1 |
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 60gHCHO和CH3COOH的混合物中存在的π键与σ键的数目总数为8NA | |
| B. | 2L0.5mol•L-1CH3COOD(D为重氢原子)溶液中,CH3COOD和DHO的微粒数之和为NA | |
| C. | 28g核素${\;}_{7}^{14}$N发生下列变化:${\;}_{7}^{14}$+${\;}_{0}^{1}$n→${\;}_{6}^{14}$+${\;}_{1}^{1}$H,通过该化学反应能生成2NA个${\;}_{1}^{1}$H | |
| D. | 450℃时,在催化剂作用下,将2molSO2与一定量的O2混合一段时间后测得SO2消耗$\frac{1}{2}$,则该正反应消耗了NA个SO2分子. |
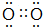 .
.