题目内容
3.下列说法错误的是( )| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1.0 mol•L-1Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
分析 A、pH=2与pH=1的CH3COOH溶液中c(H+)等于溶液中氢氧根离子浓度,pH=2的醋酸的c(OH-)=$\frac{Kω}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12;pH=1的醋酸的c(OH-)=$\frac{Kω}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-1}}$=10-13;
B、CH3COOH溶液中由水电离出的氢离子浓度等于溶液中的氢氧根离子浓度,但未告诉溶液的pH,不能计算溶液中的氢氧根离子浓度;
C、常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合后醋酸过量,溶液呈酸性;
D、1.0 mol•L-1Na2CO3溶液满足质子守恒:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-).
解答 解:A、pH=2与pH=1的CH3COOH溶液中c(H+)等于溶液中氢氧根离子浓度,pH=2的醋酸的c(OH-)=$\frac{Kω}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12;pH=1的醋酸的c(OH-)=$\frac{Kω}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-1}}$=10-13,溶液中c(H+)之比为1:10,故A正确;
B、CH3COOH溶液中由水电离出的氢离子浓度等于溶液中的氢氧根离子浓度,但未告诉溶液的pH,不能计算溶液中的氢氧根离子浓度,故B错误;
C、常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合后醋酸过量,溶液呈酸性,混合后溶液pH<7,故C正确;
D、1.0 mol•L-1Na2CO3溶液满足质子守恒:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),故D正确.
故选B.
点评 本题综合考查弱电解质的电离平衡,水溶液中pH的计算,盐类水解等知识,明确影响电离平衡的影响为解答关键,注意掌握弱电解质的电离特点,试题培养了学生的灵活应用能力.

 53随堂测系列答案
53随堂测系列答案①HA+HB-(少量)═A-+H2B
②H2B(少量)+C-═HB-+HC
③HA(少量)+C-═A-+HC
则三种酸对应的电离常数分别为(请填空)
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka | |
| 数值 | 1.8×10-5 | 4.3×10-7 | ||
| A. |  如图:可以表示CO2的比例模型 | |
| B. | 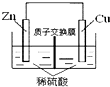 如图表示的锌铜原电池,电池工作一段时间后,右侧溶液的pH不变 | |
| C. | 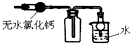 如图:可用于收集干燥氨气 | |
| D. | 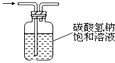 如图:可用于除去氯气中的HCl气体 |
| A. | X、Y、Z三种元素既可形成只含共价键的化合物,又可形成既含共价键又含离子键的化合物 | |
| B. | Z、W、Q三种元素所形成的简单离子的半径由大到小的顺序是W>Q>Z | |
| C. | Y的简单氢化物通入Q的氧化物的水化物水溶液中可能生成两种盐 | |
| D. | X与W组成的化合物可与水发生氧化还原反应 |
| A. | 60gHCHO和CH3COOH的混合物中存在的π键与σ键的数目总数为8NA | |
| B. | 2L0.5mol•L-1CH3COOD(D为重氢原子)溶液中,CH3COOD和DHO的微粒数之和为NA | |
| C. | 28g核素${\;}_{7}^{14}$N发生下列变化:${\;}_{7}^{14}$+${\;}_{0}^{1}$n→${\;}_{6}^{14}$+${\;}_{1}^{1}$H,通过该化学反应能生成2NA个${\;}_{1}^{1}$H | |
| D. | 450℃时,在催化剂作用下,将2molSO2与一定量的O2混合一段时间后测得SO2消耗$\frac{1}{2}$,则该正反应消耗了NA个SO2分子. |
| A. | 3种 | B. | 4种 | C. | 6种 | D. | 8种 |
| A. | M的分子式为C5H10O | |
| B. | 上述过程发生的所有反应与油脂皂化反应类型相同 | |
| C. | 该中性有机物有4种(不考虑立体异构) | |
| D. | M和N都可以发生取代反应、都能与Na反应生成H2,因此具有相同的官能团 |




 .
.