题目内容
 如图所示,该装置能否构成原电池?若能,写出电极方程式.
如图所示,该装置能否构成原电池?若能,写出电极方程式.考点:原电池和电解池的工作原理
专题:电化学专题
分析:所有自发的氧化还原反应均可以设计成原电池,负极(Fe)发生失电子的氧化反应,正极(氧气)发生还原反应,据此分析即可.
解答:
解:依据图中所示,Fe活泼性强于Cu,故作原电池的负极,失去电子,在碱性溶液中生成氢氧化亚铁沉淀,负极电极反应式为:2Fe+4OH--4e-=2Fe(OH)2↓,Cu作原电池的正极,空气中的氧气在Cu极得到电子,生成氢氧根,正极电极反应式为:O2+2H2O+4e-=4OH-,故正反应为:2Fe+O2+2H2O=2Fe(OH)2↓,
故答案为:能;负极:2Fe+4OH--4e-=2Fe(OH)2↓;
正极:O2+2H2O+4e-=4OH-;
总:2Fe+O2+2H2O=2Fe(OH)2↓.
故答案为:能;负极:2Fe+4OH--4e-=2Fe(OH)2↓;
正极:O2+2H2O+4e-=4OH-;
总:2Fe+O2+2H2O=2Fe(OH)2↓.
点评:本题考查学生原电池的工作原理知识,注意知识的归纳和整理以及电池的设计原理,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
下列说法正确的是( )
| A、C4H8O2的同分异构体中能与NaOH反应的有5种 |
| B、等质量的有机物完全燃烧后生成的CO2的量相同,则这两种有机物的实验式一定相同 |
| C、石蜡油分解的实验中,碎瓷片的作用是催化作用和积蓄热量产生高温 |
| D、将甲烷与氯气的混合气体置于密闭容器中放置光亮的地方,一段时间后,装置内的气体有甲烷、氯气、氯化氢、一氯甲烷,二氯甲烷 |
下列关于物质的检验说法不正确的是( )
| A、向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- |
| B、将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含K+ |
| C、待检液逐滴加入NaOH溶液,有白色胶状沉淀产生后来沉淀逐渐消失,则原溶液中可能含有Al3+ |
| D、待检液中先加入KSCN溶液,无明显现象,再加入氯水溶液显血红色,则待检液中一定含有Fe2+ |

 甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.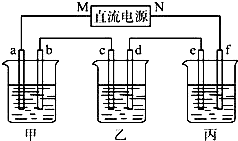 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.