题目内容
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A、根据同周期元素的电负性变化趋势,推出Cl的电负性比S大 |
| B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
| D、根据强酸可以制取弱酸的规律,推出将HCl加入到AgNO3溶液中能制备HNO3 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A.同周期元素从左到右,电负性逐渐增大;
B.F无正价;
C.温度位置,pH=7时不一定为中性;
D.反应生成沉淀,符合复分解反应的规律,但硝酸为强酸.
B.F无正价;
C.温度位置,pH=7时不一定为中性;
D.反应生成沉淀,符合复分解反应的规律,但硝酸为强酸.
解答:
解:A.同周期元素从左到右,电负性逐渐增大,S、Cl位于相同周期,Cl的原子序数角度,电负性较强,故A正确;
B.F的电负性最大,难以失去电子,无正价,故B错误;
C.温度位置,pH=7时不一定为中性,如温度在100℃时,pH=6时溶液呈中性,故C错误;
D.反应生成AgCl沉淀,符合复分解反应的规律,但硝酸为强酸,不符合强酸可以制取弱酸的规律,故D错误.
故选A.
B.F的电负性最大,难以失去电子,无正价,故B错误;
C.温度位置,pH=7时不一定为中性,如温度在100℃时,pH=6时溶液呈中性,故C错误;
D.反应生成AgCl沉淀,符合复分解反应的规律,但硝酸为强酸,不符合强酸可以制取弱酸的规律,故D错误.
故选A.
点评:本题考查同主族元素性质的相似性与递变性、溶液酸碱性判断、复分解反应规律等,为高频考点,侧重于学生的分析能力的考查,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列各组物质混合后一定没有氯气生成的是( )
| A、KMnO4,H2SO4,AlCl3 |
| B、NaClO,MgCl2,HNO3 |
| C、NaCl,NaClO4,NaClO3,Na2SO4 |
| D、KClO3,KCl,H2SO4 |
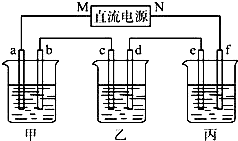 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.