题目内容
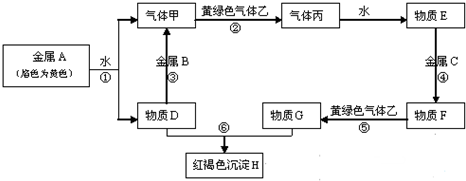
2.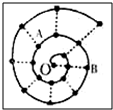 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
分析 0点代表H元素,按照原子序数由小到大由里往外延伸,由图可知,O、B连线的三元素为第ⅠA族,A为O元素,B为Na元素,C为Al元素,根据元素的种类可知虚线相连的元素处于同一族,结合对应元素的性质解答该题.
解答 解;A.离O点越远的元素原子的核电荷数增大,若电子层相同,离O点越远的元素越容易得到电子,故A错误;
B.由原子序数可知,虚线相连的元素处于同一族,故B错误;
C.B为Na元素,Na的原子半径在短周期中最大,故C正确;
D.0点代表H元素,A为O元素,B为Na元素,H与Na元素能形成NaH,故D错误.
故选C.
点评 本题考查元素周期表、元素周期律、化学键等,侧重于学生的分析能力的考查,题目难度不大,看懂图象推断元素是解题的关键,注意对元素周期表的整体把握.

练习册系列答案
相关题目
17.常温下,0.1mol/L氨水溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,下列叙述不正确的是( )
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L | |
| B. | 0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(NH3•H2O)=2c(SO42-) | |
| D. | 浓度均为0.1 mol/L的NH3•H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) |
7.下列图示与对应的叙述相符的是( )


| A. | 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图1中,b点酸的总浓度大于a点酸的总浓度 | |
| D. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
14.在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
| A. | 氯化氢 | B. | 溴水 | C. | 碘水 | D. | 氯水 |
11.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
| A. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| B. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| C. | 从海水中可以得到NaCl,电解NaCl可以制备Na | |
| D. | 利用潮汐发电是将化学能转化为电能 |