题目内容
11.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )| A. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| B. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| C. | 从海水中可以得到NaCl,电解NaCl可以制备Na | |
| D. | 利用潮汐发电是将化学能转化为电能 |
分析 A.K为活泼金属,海水中以离子形式存在;
B.海水蒸发制海盐,利用加热水转化为水蒸气,与水分离;
C.NaCl在海水中储量丰富,电解熔融NaCl可生成Na和氯气;
D.利用潮汐发电,不发生化学变化.
解答 解:A.K为活泼金属,海水中以离子形式存在,分离出KCl后电解熔融KCl得到K,为化学变化,故A错误;
B.海水蒸发制海盐,利用加热水转化为水蒸气,与水分离,无新物质生成,为物理变化,故B错误;
C.NaCl在海水中储量丰富,Na为活泼金属,则电解熔融NaCl可生成Na和氯气,故C正确;
D.利用潮汐发电,不发生化学变化,则利用潮汐发电是将机械能转化为电能,故D错误;
故选C.
点评 本题考查海水资源的利用,为高频考点,把握金属的冶炼、海水资源利用等为解答的关键,侧重分析与应用能力的考查,注意金属的存在与冶炼原理,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.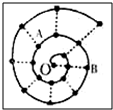 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
19. (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(2)如图1曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是F2 (填化学式).
(3)三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子间还有π键形成.
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2C12(CO)2•2H20】,其结构如图2.
①该复合物中Cl原子的杂化类型为sp3.
②该复合物中的配位体有3种.
(5)已知HF与Fˉ通过氢键结合成HF2-.判断HF2-;和HF2-微粒间能否形成氢键,并说明理由.在HF2-(F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子.
 (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.(2)如图1曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是F2 (填化学式).
(3)三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子间还有π键形成.
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
①该复合物中Cl原子的杂化类型为sp3.
②该复合物中的配位体有3种.
(5)已知HF与Fˉ通过氢键结合成HF2-.判断HF2-;和HF2-微粒间能否形成氢键,并说明理由.在HF2-(F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子.
16.下列关于物质的用途或变化,说法正确的是( )
| A. | Al2O3熔点很高,可用作熔融NaOH的坩埚材料 | |
| B. | 常温下,金属铝不被空气中的氧气氧化,因而能做导线 | |
| C. | 二氧化硅属于硅酸盐材料,玻璃钢属于复合材料 | |
| D. | 生产玻璃和水泥都要用到的原料是石灰石 |
3.下列有关离子共存或者反应的离子方程式正确的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-能共存 | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-能共存 | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.01mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 二氧化硫通入次氯酸钠碱性溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
1.下列关于核外电子排布的叙述中正确的是( )
| A. | 最外层一定为8个电子 | |
| B. | 第n层上最多容纳2n2个电子 | |
| C. | M层上的电子一定多于L层上的电子 | |
| D. | 稀有气体元素原子最外层电子数一定是所有元素中最多的 |





 .
.