题目内容
13.如图中物质均为中学化学中常见的物质,他们之间有如下转化关系.(图中有些反应的产物和反应的条件没有全部标出).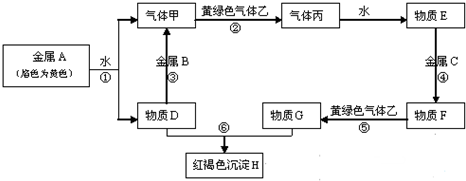
试回答:
(1)写出下列物质的化学式:丙HCl、HFe(OH)3
(2)写出反应⑤的离子方程式:2Fe2++Cl2=2Cl-+2Fe3+
(3)实验室里迅速制备少量气体乙可利用以下反应:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高.
①用“线桥法”表示出电子转移情况:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
②在该反应中,还原剂是HCl,氧化产物是Cl2.
③实验室使用容量瓶配置480mL 0.5mol/L的KMnO4溶液,应称取KMnO4固体的质量为39.5g.
分析 金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀H为Fe(OH)3;由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,盐酸与金属C反应,生成的产物F还能继续与氯气反应,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,FeCl3与红色金属I反应生成FeCl2,则I为Cu,据此答题,
(1)分析可知气体丙为氯化氢,H为氢氧化铁沉淀;
(2)反应⑤是F为FeCl2,和氯气发生的氧化还原反应生成氯化铁;
(3)①反应中KMnO4中Mn元素获得10电子生成MnCl2,HCl中Cl元素失去10个电子生成Cl2,线桥表示方法为化合价变化的同一元素用直线加箭头从反应物指向生成物,并在上方注明“得”或“失”及转移电子数目;
②所含元素化合价降低的反应物是氧化剂,所含元素氧化剂升高的反应物是还原剂;
③实验室使用容量瓶配置480mL 0.5mol/L的KMnO4溶液,实验室中无480ml的容量瓶,应在500ml的容量瓶中配制,然后取出480ml溶液,据此计算称取KMnO4固体的质量;
解答 解:金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀H为Fe(OH)3;由反应①Na→气体甲+D,为Na与水的反应,生成甲为H2,D为NaOH,由NaOH+金属B→H2可知,B为金属Al,由甲+乙→丙,故丙为HCl,HCl溶于水的物质E,故E为盐酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(盐酸)$\stackrel{金属C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,盐酸与金属C反应,生成的产物F还能继续与氯气反应,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,FeCl3与红色金属I反应生成FeCl2,则I为Cu,
(1)由上面的分析可知,气体丙为HCl,H的化学式为Fe(OH)3,
故答案为:HCl;Fe(OH)3;
(2)反应⑤是F为FeCl2,和氯气发生的氧化还原反应,反应的离子方程式为2 Fe2++Cl2=2Cl-+2 Fe3+,
故答案为:2 Fe2++Cl2=2Cl-+2 Fe3+;
(3)①反应中KMnO4中Mn元素获得10电子生成MnCl2,HCl中Cl元素失去10个电子生成Cl2.用线桥表示出该反应的电子转移情况为: ,
,
故答案为: ;
;
②反应中Mn的化合价由MnO4-中+7价降低为Mn2+中+2价,化合价降低,故KMnO4是氧化剂;氯元素的化合价由HCl中-1价升高为Cl2中0价,故HCl是还原剂,氧化产物为氯气,
故答案为:HCl; Cl2;
③实验室使用容量瓶配置480mL 0.5mol/L的KMnO4溶液,实验室中无480ml的容量瓶,应在500ml的容量瓶中配制,然后取出480ml溶液,应称取KMnO4固体的质量=0.5L×0.5mol/L×158g/mol=39.5g,
故答案为:39.5;
点评 本题以无机框图题的形式考查Na、Al、Fe、Cl等元素单质及其化合物之间的相互转化关系、化学用语的书写、离子检验等,难度中等,注意基础知识的掌握.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 钠的密度比水小 | B. | 钠的熔点低 | ||
| C. | 钠与水反应放出气体 | D. | 钠与水反应有酸生成 |
| A. |  | B. |  | C. |  | D. |  |
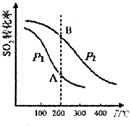 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的平衡转化率与温度、压强的关系如右图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O═2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
| A. | 水晶 | B. | 玛瑙 | C. | 石英 | D. | 硅芯片 |
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
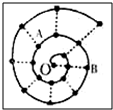 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-能共存 | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-能共存 | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.01mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 二氧化硫通入次氯酸钠碱性溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |