题目内容
7.下列图示与对应的叙述相符的是( )
| A. | 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图1中,b点酸的总浓度大于a点酸的总浓度 | |
| D. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
分析 A.醋酸是弱电解质,HCl是强电解质,加水稀释促进醋酸电离,则pH相同的盐酸和醋酸稀释相同的倍数时,醋酸中氢离子浓度大于盐酸;溶液的导电性与离子浓度成正比;
B.a点为中性,c点氢离子浓度大于氢氧根离子浓度,溶液呈酸性;
C.图1中,I是盐酸变化曲线、II是醋酸变化曲线,pH相同的醋酸和盐酸,醋酸浓度大于盐酸,稀释相同倍数,醋酸浓度大于盐酸;
D.图2中在b点对应温度下,离子积常数为10-6.10-6=10-12,pH=2的硫酸中c(H+)=0.01mol/L,pH=10的NaOH溶液中c(OH-)=0.01mol/L,二者等体积混合时,恰好完全反应生成强酸强碱盐.
解答 解:A.醋酸是弱电解质,HCl是强电解质,加水稀释促进醋酸电离,则pH相同的盐酸和醋酸稀释相同的倍数时,醋酸中氢离子浓度大于盐酸,所以I是盐酸变化曲线、II是醋酸变化曲线;溶液的导电性与离子浓度成正比,b点溶液中氢离子浓度小于a,所以a点导电性大于b,故A错误;
B.a点为中性,c点氢离子浓度大于氢氧根离子浓度,溶液呈酸性,所以单纯升高温度,纯水仍然呈中性,不能变为酸性,故B错误;
C.图1中,I是盐酸变化曲线、II是醋酸变化曲线,pH相同的醋酸和盐酸,醋酸浓度大于盐酸,稀释相同倍数,醋酸浓度大于盐酸,所以图1中,b点酸的总浓度小于a点酸的总浓度,故C错误;
D.图2中在b点对应温度下,离子积常数为10-6.10-6=10-12,pH=2的硫酸中c(H+)=0.01mol/L,pH=10的NaOH溶液中c(OH-)=0.01mol/L,二者等体积混合时,恰好完全反应生成强酸强碱盐,溶液呈中性,故D正确;
故选D.
点评 本题考查弱电解质的电离、酸碱混合溶液定性判断等知识点,明确图中曲线变化趋势及纵横坐标含义是解本题关键,注意图2中温度不同导致水的离子积常数不同,题目难度不大.

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | 锌是正极,铜是负极 | B. | H+在溶液里流向锌片 | ||
| C. | 负极发生还原反应 | D. | 电子经外电路由锌流向铜 |
| A. | 水晶 | B. | 玛瑙 | C. | 石英 | D. | 硅芯片 |
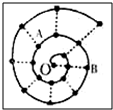 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
有关数据记录如表:
| 加硫酸的次数序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 7.20 |
| 2 | 20.0 | 4.40 |
| 3 | 20.0 | 2.00 |
| 4 | 20.0 | 2.00 |
(2)请计算所用硫酸溶液中硫酸的物质的量浓度.
 (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.(2)如图1曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是F2 (填化学式).
(3)三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子间还有π键形成.
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
①该复合物中Cl原子的杂化类型为sp3.
②该复合物中的配位体有3种.
(5)已知HF与Fˉ通过氢键结合成HF2-.判断HF2-;和HF2-微粒间能否形成氢键,并说明理由.在HF2-(F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子.
| A. | Al2O3熔点很高,可用作熔融NaOH的坩埚材料 | |
| B. | 常温下,金属铝不被空气中的氧气氧化,因而能做导线 | |
| C. | 二氧化硅属于硅酸盐材料,玻璃钢属于复合材料 | |
| D. | 生产玻璃和水泥都要用到的原料是石灰石 |
| A. |  | B. |  | C. |  | D. |  |
