题目内容
16.将一定质量的铁粉与氢氧化铁的混合物在氧气中灼烧至质量不再改变为止,发现加热前后混合物的质量无变化,则混合物中铁和氢氧化铁物质的量之比为81:64.分析 将一定质量的铁粉与氢氧化铁的混合物在氧气中灼烧至质量不再改变为止,最终生成Fe3O4、Fe2O3,加热前后混合物的质量无变化,则四氧化三铁中氧元素质量等于氢氧化铁分解生成水的质量.
解答 解:将一定质量的铁粉与氢氧化铁的混合物在氧气中灼烧至质量不再改变为止,最终生成Fe3O4、Fe2O3,加热前后混合物的质量无变化,则四氧化三铁中氧元素质量等于氢氧化铁分解生成水的质量.
设混合物中Fe为xmol,则生成Fe3O4为$\frac{1}{3}$x mol,设氢氧化铁为ymol,则其分解生成水为$\frac{ymol×3}{2}$=1.5y mol,故$\frac{1}{3}$x mol×4×16g/mol=1.5y mol×18g/mol,整理可得:x:y=81:64,
故答案为:81:64.
点评 本题考查混合物计算,属于无数据型计算,明确发生的反应,关键是对质量守恒定律的理解,侧重考查学生分析计算能力.

练习册系列答案
相关题目
6.下列关于有机化合物的说法正确的是( )
| A. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 糖类、油脂和蛋白质均可发生水解反应 | |
| D. | 油脂皂化反应得到高级脂肪酸盐与甘油 |
7.近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸是这种饮料的主要酸性物质,苹果酸的结构简式如图所示,下列说法正确的是( )

| A. | 苹果酸发生酯化反应的官能团有2种 | |
| B. | 1mol苹果酸与3molNaOH发生中和反应 | |
| C. | 1mol苹果酸与足量Na反应放出1molH2 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
1.下表是元素周期表的一部分,针对表中的①-⑧种元素,填写下列空白;
(1)上述元素中,形成化合物种类最多的是C(填元素符号);
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
4.液氧是航天活动一种重要氧化剂,常与液氢或煤油等配合使用,以下说法错误的是( )
| A. | 工业通过分馏液态空气制备液氧 | |
| B. | 液氧不可燃,铁路旅客可以随身携带 | |
| C. | 液氧与液氢搭配做火箭推进剂的优点之一是清洁环保 | |
| D. | 沥青若长时间浸入液氧可能会发生爆炸 |

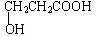 ;若甲能发生银镜反应,则甲的结构简式为
;若甲能发生银镜反应,则甲的结构简式为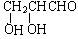 .
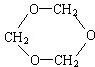
.
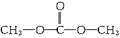 .
.