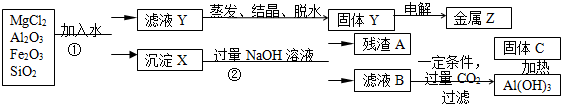
题目内容
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 .
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化.晶体熔点:DC EC(填“<、=、>”)
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解是 ;
(4)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
(5)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式 (写一个)
(1)A、B、C的第一电离能由小到大的顺序为
(2)A的氢化物的分子空间构型是
(3)F和M(质子数为25)两元素的部分电离能数据列于如表:
| 元 素 | M | F | |
| 电离能 (kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
(5)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大,A、C原子的L层有2个未成对电子,电子排布图分别为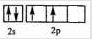 、
、 ,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素,结合元素对应原子的结构、单质及化合物的性质解答该题.
,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素,结合元素对应原子的结构、单质及化合物的性质解答该题.
 、
、 ,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素,结合元素对应原子的结构、单质及化合物的性质解答该题.
,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素,结合元素对应原子的结构、单质及化合物的性质解答该题.解答:
解:A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大,A、C原子的L层有2个未成对电子,电子排布图分别为 、
、 ,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素;
,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素;
(1)同周期元素从左到右元素的第一电离能呈增大趋势,由于N的2p电子为半充满状态性质稳定,则第一电离能大于O,则有C<O<N,
故答案为:C<O<N;
(2)A为碳元素,其氢化物为CH4,分子中含有4个C-H键,杂化轨道数为4,C原子采取sp3杂化,空间构型为正四面体;DC为MgO,EC为CaO,均为离子晶体,离子半径越大,晶体的熔点越低,镁离子的半径小于钙离子的半径,则熔点:MgO>CaO;
故答案为:正四面体;sp3;>;
(3)质子数为25的元素为Mn,Mn2+的3d轨道电子排布为半满状态较稳定,则再失去一个电子比气态Fe2+再失去一个电子难,
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定;
(4)O的电负性较大,形成的氢化物H2O2含有氢键,与水分子可形成氢键,则沸点较高,故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(5)已知某化合反应,在反应过程中只有σ键的断裂与生成,说明反应物和生成物中只含有单键,反应H2+Cl2
2HCl 符合条件,故答案为:H2+Cl2
2HCl.
 、
、 ,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素;
,原子序数A小于C,则A为C元素,C为O元素,则B为N元素;D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素,E为Ca元素;F3+离子M层3d轨道电子为半满状态,则离子的核外电子数为23,F的原子序数为26,应为Fe元素;(1)同周期元素从左到右元素的第一电离能呈增大趋势,由于N的2p电子为半充满状态性质稳定,则第一电离能大于O,则有C<O<N,
故答案为:C<O<N;
(2)A为碳元素,其氢化物为CH4,分子中含有4个C-H键,杂化轨道数为4,C原子采取sp3杂化,空间构型为正四面体;DC为MgO,EC为CaO,均为离子晶体,离子半径越大,晶体的熔点越低,镁离子的半径小于钙离子的半径,则熔点:MgO>CaO;
故答案为:正四面体;sp3;>;
(3)质子数为25的元素为Mn,Mn2+的3d轨道电子排布为半满状态较稳定,则再失去一个电子比气态Fe2+再失去一个电子难,
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定;
(4)O的电负性较大,形成的氢化物H2O2含有氢键,与水分子可形成氢键,则沸点较高,故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(5)已知某化合反应,在反应过程中只有σ键的断裂与生成,说明反应物和生成物中只含有单键,反应H2+Cl2
| ||
| ||
点评:本题目综合性较大,涉及结构性质与位置关系、元素周期律、核外电子排布规律、电离能、氢键等,题目难度中等,是物质结构的综合性题目,是对学生综合能力的考查,原子的核外电子排布规律是推断的突破口.

练习册系列答案
相关题目
日本福岛第一核电站泄漏出微量的钚(Pu)-239.下列关于
Pu叙述准确的是( )
239 94 |
| A、原子序数是239 |
| B、质量数是94 |
| C、中子数是239 |
| D、质子数是94 |
下列说法正确的是( )
| A、用粮食酿酒的过程中,不可能生成乙酸 |
| B、乙醇和乙酸互为同分异构体 |
| C、氨基酸、蛋白质和纤维素均属于高分子化合物 |
| D、乙烯能使溴的四氯化碳溶液褪色,与乙烯分子含有碳碳双键有关 |
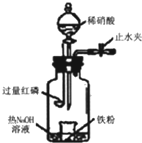 某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究.
某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究.