题目内容
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,他们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、V形、直线型.请回答下列问题:
(1)写出工业制E的氢化物的化学方程式
(2)Z在元素周期表中位于 族,Z的单质与强碱溶液反应的离子方程式
(3)试比较D和X的最高价氧化物熔点的高低并说明理由
(4)写出Y的氧化物的化学式 、 .
(1)写出工业制E的氢化物的化学方程式
(2)Z在元素周期表中位于
(3)试比较D和X的最高价氧化物熔点的高低并说明理由
(4)写出Y的氧化物的化学式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、V形、直线型,形成正四面体结构的氢化物是甲烷或硅烷,形成三角锥型的氢化物是氨气,形成V型的氢化物是水或硫化氢,形成直线型结构的氢化物是乙炔、氟化氢或氯化氢,这几种元素的原子序数逐渐增大,所以D的氢化物是甲烷,E的氢化物是氨气,X的氢化物是硅烷,Y的氢化物是硫化物,Z的氢化物是氯化氢,则D、E、X、Y、Z分别是C、N、Si、S、Cl元素,据此解答各小题即可.
解答:
解:依据分析可知:D、E、X、Y、Z分别是C、N、Si、S、Cl,
(1)工业上制取氨气的化学反应方程式为:N2+3H2
2NH3,故答案为:N2+3H2
2NH3;
(2)Z是Cl,Cl处于第三周期第VIIA族,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,单质与水不能拆,故离子反应方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:第三周期第VIIA,Cl2+2OH-═Cl-+ClO-+H2O;
(3)C和Si的最高价氧化物分别为CO2、SiO2,由于二氧化碳是分子晶,融化破坏的是分子间作用力,二氧化硅是原子晶体,融化时破坏的是共价键,故CO2的熔点小于SiO2,
故答案为:CO2<SiO2,二氧化碳是分子晶,融化破坏的是分子间作用力,二氧化硅是原子晶体,融化时破坏的是共价键;
(4)S的氧化物有两种,分别为二氧化硫和三氧化硫,化学式为:SO2,SO3.
(1)工业上制取氨气的化学反应方程式为:N2+3H2
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
(2)Z是Cl,Cl处于第三周期第VIIA族,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,单质与水不能拆,故离子反应方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:第三周期第VIIA,Cl2+2OH-═Cl-+ClO-+H2O;
(3)C和Si的最高价氧化物分别为CO2、SiO2,由于二氧化碳是分子晶,融化破坏的是分子间作用力,二氧化硅是原子晶体,融化时破坏的是共价键,故CO2的熔点小于SiO2,
故答案为:CO2<SiO2,二氧化碳是分子晶,融化破坏的是分子间作用力,二氧化硅是原子晶体,融化时破坏的是共价键;
(4)S的氧化物有两种,分别为二氧化硫和三氧化硫,化学式为:SO2,SO3.
点评:本题考查元素及其化合物的性质、分子空间构型等知识点,明确常见分子的空间构型是解本题的关键,为高考热点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.5mol空气在标准状况下占有的体积是( )
| A、22.4L |
| B、33.6L |
| C、44.8L |
| D、67.2L |
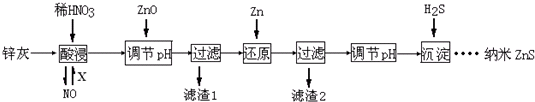
某同学设计了以下流程来检验碳酸钾粉末中含有少量氯化钾和氢氧化钾.下列说法不正确的是( )
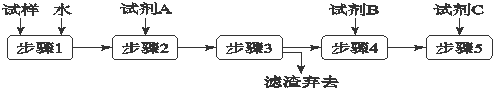

| A、步骤3的操作名称是过滤 |
| B、步骤1所需玻璃仪器是烧杯和玻璃棒 |
| C、试剂A是BaCl2溶液 |
| D、加入试剂A 的目的是除去CO32-并避免对Cl-或OH-的检验的干扰 |
下列关于食物酸碱性的说法错误的是( )
| A、食物的酸碱性是按食物在体内代谢最终产物的性质来分类的 |
| B、酸性食物在体内代谢后可形成阴离子酸根 |
| C、碱性食物在体内代谢后可形成含金属阳离子的碱性物质 |
| D、某些水果酸味很强,它们是酸性食物 |