题目内容
下表如图1是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.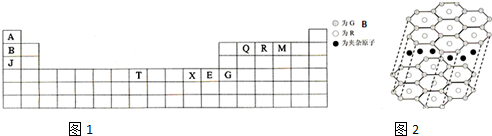
(1)T3+的核外电子排布式是: .
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示).
(3)下列有关上述元素的说法中,正确的是 (填序号).
①B单质的熔点高于J单质,是因为B单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RA3沸点高于QA4,主要是因为前者相对分子质量较大
⑤一个Q2A4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了AQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键.写出其结构式: .
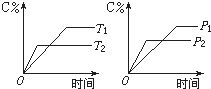
(5)B与R单质直接化合生成一种离子化合物B3R.该晶体具有类似石墨的层状结构如图2.每层中,B原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是 (填B或R的元素符号).
(6)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但G的第一电离能却明显低于E,原因是 .

(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是
(3)下列有关上述元素的说法中,正确的是
①B单质的熔点高于J单质,是因为B单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RA3沸点高于QA4,主要是因为前者相对分子质量较大
⑤一个Q2A4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了AQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键.写出其结构式:
(5)B与R单质直接化合生成一种离子化合物B3R.该晶体具有类似石墨的层状结构如图2.每层中,B原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是
(6)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但G的第一电离能却明显低于E,原因是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A、B、Q、R、M、J、T、X、E、G分别是H、Li、C、N、O、Na、Fe、Cu、Zn、Ga元素,
(1)T是Fe元素,Fe3+的核外电子有23个,根据构造原理书写其核外电子排布式;
(2)C、N、O是同一周期元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于其相邻元素;
(3)①B是Li、J是Na,碱金属元素单质的熔沸点随着原子序数增大而减小;
②J是Na元素、X是Cu元素,Na先和盐溶液中水反应生成NaOH,然后再和铜离子发生复分解反应;
③Na2O2溶于水生成氢氧化钠和氧气,所以要破坏离子键和共价键;
④NH3沸点高于CH4,氢键导致氢化物熔沸点升高;
⑤一个C2H4分子中含有五个σ键和一个π键;
(4)HC9N,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键,则该分子中存在C≡C、C≡N;
(5)Li与N化合生成离子化合物Li3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子数为6×
=2;
(6)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但Ga的第一电离能却明显低于Zn,原子轨道处于全满、全空、半空时较稳定.
(1)T是Fe元素,Fe3+的核外电子有23个,根据构造原理书写其核外电子排布式;
(2)C、N、O是同一周期元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于其相邻元素;
(3)①B是Li、J是Na,碱金属元素单质的熔沸点随着原子序数增大而减小;
②J是Na元素、X是Cu元素,Na先和盐溶液中水反应生成NaOH,然后再和铜离子发生复分解反应;
③Na2O2溶于水生成氢氧化钠和氧气,所以要破坏离子键和共价键;
④NH3沸点高于CH4,氢键导致氢化物熔沸点升高;
⑤一个C2H4分子中含有五个σ键和一个π键;
(4)HC9N,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键,则该分子中存在C≡C、C≡N;
(5)Li与N化合生成离子化合物Li3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子数为6×
| 1 |
| 3 |
(6)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但Ga的第一电离能却明显低于Zn,原子轨道处于全满、全空、半空时较稳定.
解答:
解:A、B、Q、R、M、J、T、X、E、G分别是H、Li、C、N、O、Na、Fe、Cu、Zn、Ga元素,
(1)T是Fe元素,Fe3+的核外电子有23个,根据构造原理知其核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5,故答案为:[Ar]3d5或1s22s22p63s23p63d5;
(2)C、N、O是同一周期元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)①B是Li、J是Na,碱金属元素单质的熔沸点随着原子序数增大而减小,金属键越强,其单质的熔沸点越高,故正确;
②J是Na元素、X是Cu元素,Na先和盐溶液中水反应生成NaOH,然后再和铜离子发生复分解反应,所以不能置换出Cu单质,故错误;
③Na2O2溶于水生成氢氧化钠和氧气,所以要破坏钠离子和过氧根离子之间的离子键和过氧根离子中的共价键,故正确;
④NH3沸点高于CH4,氨气中存在氢键、甲烷中不含氢键,氢键导致氢化物熔沸点升高,所以氨气沸点大于甲烷,故错误;
⑤一个C2H4分子中含有五个σ键和一个π键,C原子之间存在π键,故正确;
故选①③⑤;
(4)HC9N,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键,则该分子中存在C≡C、C≡N,所以其结构式为H-C≡C-C≡C-C≡C-C≡C-C≡N,故答案为:H-C≡C-C≡C-C≡C-C≡C-C≡N;
(5)每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子水为6×
=2,Li3N中离子个数为3:1,所以层与层之间还原子为Li,故答案为:Li;
(6)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但Ga的第一电离能却明显低于Zn,原子轨道处于全满、全空、半空时较稳定,当Ga失去1个电子后内层电子达到全充满的稳定状态,所以Ga的第一电离能却明显低于Zn,
故答案为:Ga失去1个电子后内层电子达到全充满的稳定状态.
(1)T是Fe元素,Fe3+的核外电子有23个,根据构造原理知其核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5,故答案为:[Ar]3d5或1s22s22p63s23p63d5;
(2)C、N、O是同一周期元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)①B是Li、J是Na,碱金属元素单质的熔沸点随着原子序数增大而减小,金属键越强,其单质的熔沸点越高,故正确;
②J是Na元素、X是Cu元素,Na先和盐溶液中水反应生成NaOH,然后再和铜离子发生复分解反应,所以不能置换出Cu单质,故错误;
③Na2O2溶于水生成氢氧化钠和氧气,所以要破坏钠离子和过氧根离子之间的离子键和过氧根离子中的共价键,故正确;
④NH3沸点高于CH4,氨气中存在氢键、甲烷中不含氢键,氢键导致氢化物熔沸点升高,所以氨气沸点大于甲烷,故错误;
⑤一个C2H4分子中含有五个σ键和一个π键,C原子之间存在π键,故正确;
故选①③⑤;
(4)HC9N,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键,则该分子中存在C≡C、C≡N,所以其结构式为H-C≡C-C≡C-C≡C-C≡C-C≡N,故答案为:H-C≡C-C≡C-C≡C-C≡C-C≡N;
(5)每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子水为6×
| 1 |
| 3 |
(6)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但Ga的第一电离能却明显低于Zn,原子轨道处于全满、全空、半空时较稳定,当Ga失去1个电子后内层电子达到全充满的稳定状态,所以Ga的第一电离能却明显低于Zn,
故答案为:Ga失去1个电子后内层电子达到全充满的稳定状态.
点评:本题考查分子结构、氢键、金属键、核外电子排布、电离能等知识点,综合性较强,熟悉物质结构、原子结构、基本理论等知识点即可解答,难点和易错点是(4)(5)题,题目难度中等.

练习册系列答案
相关题目
下列溶液中各微粒的浓度关系正确的是( )
| A、醋酸钠中加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
| C、1.0 mol?L -1Na2CO3溶液:c(OH-)=2c(HCO3-)+c(H+)+c(H2CO3) |
| D、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):(NH4)2SO4>NH4HSO4>NH4Cl |
反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
| A、υ(D)=0.4 mol/(L?s) |
| B、υ(C)=0.6mol/(L?s) |
| C、υ(B)=0.5mol/(L?s) |
| D、υ(A)=0.15 mol/(L?s) |
 可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )
可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )| A、到达平衡后,若使用催化剂,C的质量分数增大 |
| B、平衡后,若升高温度,平衡则向逆反应方向移动 |
| C、平衡后,增大A的量,有利于平衡向正反应方向移动 |
| D、化学方程式中一定n>p+q |
有按如下特点排列的一系列(n种)稠环芳香烃:
①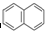 ②
② ③
③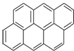 ④
④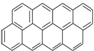 …该系列化合物中所含碳的质量分数最大值是( )
…该系列化合物中所含碳的质量分数最大值是( )
①
 ②
② ③
③ ④
④ …该系列化合物中所含碳的质量分数最大值是( )
…该系列化合物中所含碳的质量分数最大值是( )| A、93.8% | B、95.7% |
| C、97.3% | D、无法确定 |
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )

| A、该电池能够在高温下工作 | ||
| B、放电过程中,H+从正极区向负极区迁移 | ||
| C、电池的负极反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | ||
D、在电池反应中,每消耗1 mol 氧气,理论上能生成标准状况下CO2气体
|
下列各反应中电子转移情况表示正确的是( )
A、 |
B、 |
C、 |
D、 |
