题目内容
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的一种单质具有特殊臭味,Z与X原子最处层电子数相同.回答下列问题:
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式 ;
(2)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键.此化合物可将碱性工业废水中CN-氧化为碳酸盐和氨,相应的离子方程式为 .
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式
(2)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键.此化合物可将碱性工业废水中CN-氧化为碳酸盐和氨,相应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,则X为H元素;
Y的一种单质具有特殊臭味,该单质为臭氧,则Y为O元素;Z与X原子最外层电子数相同,Z的原子序数大于O元素,则Z是钠元素,
根据分析可知,X为H元素、Y为为O元素、Z是Na元素.
Y的一种单质具有特殊臭味,该单质为臭氧,则Y为O元素;Z与X原子最外层电子数相同,Z的原子序数大于O元素,则Z是钠元素,
根据分析可知,X为H元素、Y为为O元素、Z是Na元素.
解答:
解:X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,则X为H元素;Y的一种单质具有特殊臭味,该单质为臭氧,则Y为O元素;Z与X原子最外层电子数相同,Z的原子序数大于O元素,则Z是Na元素,
(1)根据分析可知,X为H元素、Y为为O元素、Z是Na元素,由H、O、Na元素组成的化合物中,既含有极性共价键又含有离子键的化合物为NaOH,氢氧化钠属于离子化合物,氢氧化钠的电子式为: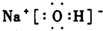 ,
,
故答案为: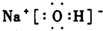 ;
;
(2)X为H元素、Y为为O元素,X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中CN-氧化为碳酸盐和氨,该化合物具有氧化性,则该化合物为H2O2,过氧化氢在碱性工业废水中的CN-氧化为碳酸盐和氨,反应的离子方程式为:H2O2+CN-+OH-=CO32-+NH3,
故答案为:H2O2+CN-+OH-=CO32-+NH3.
(1)根据分析可知,X为H元素、Y为为O元素、Z是Na元素,由H、O、Na元素组成的化合物中,既含有极性共价键又含有离子键的化合物为NaOH,氢氧化钠属于离子化合物,氢氧化钠的电子式为:
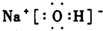 ,
,故答案为:
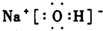 ;
;(2)X为H元素、Y为为O元素,X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中CN-氧化为碳酸盐和氨,该化合物具有氧化性,则该化合物为H2O2,过氧化氢在碱性工业废水中的CN-氧化为碳酸盐和氨,反应的离子方程式为:H2O2+CN-+OH-=CO32-+NH3,
故答案为:H2O2+CN-+OH-=CO32-+NH3.
点评:本题考查了元素位置结构性质的关系,题目难度中等,熟悉元素周期表结构是解本题关键,根据原子结构来推断元素,再结合物质的结构、性质来分析解答.

练习册系列答案
相关题目
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成.下列说法正确的是( )
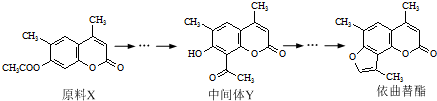

| A、原料X酸性条件下水解产物与中间体Y互为同分异构体 |
| B、原料X不能使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、氧化等反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
1mol跟足量 的NaOH溶液反应,消耗NaOH物质的量最多为( )
的NaOH溶液反应,消耗NaOH物质的量最多为( )
 的NaOH溶液反应,消耗NaOH物质的量最多为( )
的NaOH溶液反应,消耗NaOH物质的量最多为( )| A、4n mol |
| B、5 mol |
| C、5n mol |
| D、6n mol |
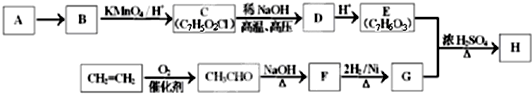
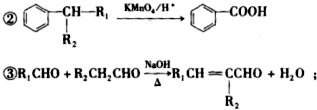 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)