题目内容
碳元素是形成物种最多的元素之一,其中许多物质对人类来说有着极其重要的作用.
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世上最薄却也是最坚硬的纳米材料,同时也是世界上导电性最好的材料(结构见图1).
试预测它与下列物质可能反应的是 .
A.氧气 B.单质氟 C.浓硝酸 D.氢氧化钠溶液
(2)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=a kJ?mol-1;
②CH3OH(g)=CO(g)+2H2(g)△H=bkJ?mol-1;
CH4(g)与H2O (g)反应生成CH3OH(g)和H2(g)的热化学方程式为 .
(3)柠檬酸(H3Cit)是重要的三元有机酸,它的三种铵盐均易溶于水,它们可通过H3Cit与氨水反应获得,含碳各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系见图2. ①为制取NH4H2Cit,pH应控制在 ;
②柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,该反应的离子方程式为 .
(4)锌溴液流电池是一种新型电化学储能装置(如图3所示),电解液为溴化锌水 溶液,电解液在电解质储罐和电池间不断循环.充电时b为电源的 (填“正极”、“负极”、“阳极”或“阴极”);放电时正极的电极反应式: .
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世上最薄却也是最坚硬的纳米材料,同时也是世界上导电性最好的材料(结构见图1).
试预测它与下列物质可能反应的是
A.氧气 B.单质氟 C.浓硝酸 D.氢氧化钠溶液
(2)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=a kJ?mol-1;
②CH3OH(g)=CO(g)+2H2(g)△H=bkJ?mol-1;
CH4(g)与H2O (g)反应生成CH3OH(g)和H2(g)的热化学方程式为
(3)柠檬酸(H3Cit)是重要的三元有机酸,它的三种铵盐均易溶于水,它们可通过H3Cit与氨水反应获得,含碳各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系见图2. ①为制取NH4H2Cit,pH应控制在
②柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,该反应的离子方程式为
(4)锌溴液流电池是一种新型电化学储能装置(如图3所示),电解液为溴化锌水 溶液,电解液在电解质储罐和电池间不断循环.充电时b为电源的

考点:热化学方程式,化学电源新型电池
专题:
分析:(1)根据碳单质的性质结合碳单质和硅单质性质的相似性来回答;
(2)根据盖斯定律来计算化学反应的焓变,并书写热化学方程式;
(3)①根据图示信息确定制取NH4H2Cit的pH范围;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子;
(4)根据图示的信息,结合原电池等工作原理,原电池的负极是金属锌失电子的过程,所以b是负极,a是正极,根据充电时,电池的正极和电源的正极相接,负极和电源的负极相接;原电池的两极反应中,正极上发生得电子的还原反应.
(2)根据盖斯定律来计算化学反应的焓变,并书写热化学方程式;
(3)①根据图示信息确定制取NH4H2Cit的pH范围;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子;
(4)根据图示的信息,结合原电池等工作原理,原电池的负极是金属锌失电子的过程,所以b是负极,a是正极,根据充电时,电池的正极和电源的正极相接,负极和电源的负极相接;原电池的两极反应中,正极上发生得电子的还原反应.
解答:
解:(1)根据碳单质的性质可以和氧气在点燃下反应,可以和浓硝酸加热下反应,碳单质可以和氟气之间反应,故答案为:ABC;
(2)已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=a kJ?mol-1;
②CH3OH(g)═CO(g)+2H2(g)△H=bkJ?mol-1;
根据盖斯定律,反应CH4(g)+H2O(g)=CH3OH(g)+H2(g),可以是①-②得到,所以该反应的△H=(a-b)kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=(a-b)kJ/mol;
(3)①根据图示信息知道,H2Cit-存在的pH范围大约在4左右,故答案为:3.8~4.2;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子,所以反应的离子方程式为2H3Cit+5NH3?H2O=HCit2-+Cit3-+5NH4++5H2O,故答案为:2H3Cit+5NH3?H2O=HCit2-+Cit3-+5NH4++5H2O;
(4)根据图示的信息,结合原电池等工作原理,原电池的负极是金属锌失电子的过程,所以b是负极,a是正极,根据充电时,电池的正极和电源的正极相接,负极和电源的负极相接,所以充电时b为电源的负极,放电时,正极上发生得电子的还原反应,反应为:Br2+2e-=2Br-,故答案为:负极;Br2+2e-=2Br-.
(2)已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=a kJ?mol-1;
②CH3OH(g)═CO(g)+2H2(g)△H=bkJ?mol-1;
根据盖斯定律,反应CH4(g)+H2O(g)=CH3OH(g)+H2(g),可以是①-②得到,所以该反应的△H=(a-b)kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=(a-b)kJ/mol;
(3)①根据图示信息知道,H2Cit-存在的pH范围大约在4左右,故答案为:3.8~4.2;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子,所以反应的离子方程式为2H3Cit+5NH3?H2O=HCit2-+Cit3-+5NH4++5H2O,故答案为:2H3Cit+5NH3?H2O=HCit2-+Cit3-+5NH4++5H2O;
(4)根据图示的信息,结合原电池等工作原理,原电池的负极是金属锌失电子的过程,所以b是负极,a是正极,根据充电时,电池的正极和电源的正极相接,负极和电源的负极相接,所以充电时b为电源的负极,放电时,正极上发生得电子的还原反应,反应为:Br2+2e-=2Br-,故答案为:负极;Br2+2e-=2Br-.
点评:本题涉及碳单质的性质、电化学、热化学等方面的知识的考查,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
1mol跟足量 的NaOH溶液反应,消耗NaOH物质的量最多为( )
的NaOH溶液反应,消耗NaOH物质的量最多为( )
 的NaOH溶液反应,消耗NaOH物质的量最多为( )
的NaOH溶液反应,消耗NaOH物质的量最多为( )| A、4n mol |
| B、5 mol |
| C、5n mol |
| D、6n mol |
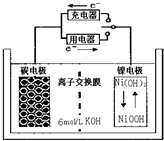 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池用6mol/L 的KOH溶液作电解质溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池用6mol/L 的KOH溶液作电解质溶液,下列说法中正确的是( )| A、充电时OH-向碳电极移动 |
| B、充电时将镍电极与电的负极相连 |
| C、放电时碳电极反应为:H2-2e-=2H+ |
| D、放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
某温度下重水中存在电离平衡D2O?D++OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是( )
| A、0.1molNaOD溶于重水制成1L溶液,pD=13 |
| B、将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=6 |
| C、向30mL0.5mol?L-1NaOD的重水溶液中加入20mL0.5mol?L-1DCl的重水溶液,所得溶液pD=13 |
| D、pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol?L-1 |
下列离子方程式书写正确的是( )
| A、硝酸银溶液中加入铜粉:Ag++Cu=Cu2++Ag |
| B、过氧化钠投入水中发生反应:2O22-+2H2O=4OH-+O2↑ |
| C、向澄清石灰水中通入足量二氧化碳:OH-+CO2=HCO3- |
| D、金属铝溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
下列化工生产原理错误的是( )
①可以电解熔融的氯化钠来制取金属钠;
②可以将钠加入氯化镁饱和溶液中制取镁;
③用电解法冶炼铝时,原料是氯化铝;
④高炉炼铁的反应是放热的,故无需加热.
①可以电解熔融的氯化钠来制取金属钠;
②可以将钠加入氯化镁饱和溶液中制取镁;
③用电解法冶炼铝时,原料是氯化铝;
④高炉炼铁的反应是放热的,故无需加热.
| A、②③ | B、①③ |
| C、①②③ | D、②③④ |
下列离子方程式书写正确的是( )
| A、大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、氯化镁溶液中滴入氢氧化钠溶液:MgCl2+2OH-═Mg(OH)2↓+2Cl- |
| D、氯化钡溶液与稀硫酸混合:Ba2++SO42-=BaSO4↓ |