题目内容
有按如下特点排列的一系列(n种)稠环芳香烃:
①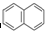 ②
② ③
③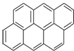 ④
④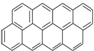 …该系列化合物中所含碳的质量分数最大值是( )
…该系列化合物中所含碳的质量分数最大值是( )
①
 ②
② ③
③ ④
④ …该系列化合物中所含碳的质量分数最大值是( )
…该系列化合物中所含碳的质量分数最大值是( )| A、93.8% | B、95.7% |
| C、97.3% | D、无法确定 |
考点:芳香烃、烃基和同系物
专题:
分析:从A、B、C的结构简式可知,其分子式分别为C10H8、C16H10、C22H12,从分子式可知,每增加两个苯环,分子中就增加6个碳原子,增加2个氢原子,故该系列化合物的通式为C6n+4H2n+6,ω(C)=
,当n→+∞时,ω(C)的取最大值;
| 12(6n+4) |
| 12(6n+4)+2n+6 |
解答:
解:(1)从A、B、C的结构简式可知,其分子式分别为C10H8、C16H10、C22H12,从分子式可知,每增加两个苯环,分子中就增加6个碳原子,增加2个氢原子,故该系列化合物的通式为C6n+4H2n+6,ω(C)=
=
=
,当n→+∞时,ω(C)的最大值为
=97.3%,故选C.
| 12(6n+4) |
| 12(6n+4)+2n+6 |
| 36n+24 |
| 37n+27 |
36+
| ||
37+
|
| 36 |
| 37 |
点评:本题考查有机物通式的判断、质量分数的计算,难度较大,得出通式是解题关键.

练习册系列答案
相关题目
实验室进行下列实验时,温度计水银球置于反应物液面以下的是( )
| A、乙醇和浓硫酸混合加热,制乙烯 |
| B、从石油中提炼汽油 |
| C、用蒸馏方法提纯水 |
| D、实验室制取溴苯 |
对于平衡体系mA(g)+nB(g)?pC(g)+qD(g);△H<0.下列结论中不正确的是( )
| A、若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小 |
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
| D、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
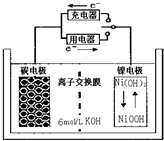 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池用6mol/L 的KOH溶液作电解质溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池用6mol/L 的KOH溶液作电解质溶液,下列说法中正确的是( )| A、充电时OH-向碳电极移动 |
| B、充电时将镍电极与电的负极相连 |
| C、放电时碳电极反应为:H2-2e-=2H+ |
| D、放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
某温度下重水中存在电离平衡D2O?D++OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是( )
| A、0.1molNaOD溶于重水制成1L溶液,pD=13 |
| B、将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=6 |
| C、向30mL0.5mol?L-1NaOD的重水溶液中加入20mL0.5mol?L-1DCl的重水溶液,所得溶液pD=13 |
| D、pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol?L-1 |
用NA表示阿伏加德罗常数.下列说法中,正确的是( )
| A、2.0g重水(2H2O)中含有的质子数为1.0 NA |
| B、0.1mol丙烯酸中含有双键的数目为0.1NA |
| C、标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA |
| D、标准状况下,2.24L苯中含有的C-H键的数目为0.6NA |