题目内容
13. 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.(1)已知H2(g)和C(s)的燃烧热分别是285.8kJ•mol-1、393.5kJ•mol-1;计算反应
4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为△H=-378.8kJ/mol;
(2)工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g)?CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是ad(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将变小(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将变小;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH-12e-=2CO2-3+11H2O;
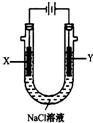
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y电极附近观察到的现象Y电极附近溶液中有气体产生,上部分呈黄绿色;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=14(假设溶液的体积不变,气体全部从溶液中逸出).
分析 (1)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式;
依据燃烧热写出热化学方程式,结合盖斯定律计算得到所需热化学方程式和对应焓变;
(2)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断.
②根据反应放热,故升高温度,平衡左移,据此判断CH3OCH3的产率和混合气体的平均式量M=$\frac{m}{n}$;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;
(4)惰性电极电解饱和食盐水,Y电极是阳极,溶液中氯离子失电子生成氯气;依据原电池和电解池中存在的电子守恒结合电极反应计算溶液PH.
解答 解:(1)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
H2(g)和C(s)的燃烧热分别是285.8kJ•mol-1、393.5kJ•mol-1;热化学方程式
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;
②C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol;
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
依据盖斯定律计算①×3+②×2-③得到反应热化学方程式为:2C(s)+3H2(g)+$\frac{1}{2}$O2(g)═CH2OCH3(g):△H=-169.4kJ/mol;
4C(s)+6H2(g)+O2(g)═2CH2OCH3(g):△H=-338.8kJ/mol;
故答案为:△H=-378.8kJ/mol;
(2)①a、在反应达平衡前,c(H2)与c(H2O)的比值在变小,故当c(H2)与c(H2O)的比值保持不变时,反应达平衡,故a选;
b、单位时间内有2mol H2消耗时一定会有1mol H2O生成,故不能作为平衡的标志,故b不选;
c、本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量一直不变,而又是恒容的容器,即气体体积不变,故气体密度ρ=$\frac{m}{V}$直不变,故密度不变不能作为平衡的标志,故c不选;
d、此反应是个气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡,故d选.
故选ad;
②反应放热,故升高温度,平衡左移,故CH3OCH3的产率将变小;本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量m一直不变,而升温后平衡左移,气体的物质的量变大,故混合气体的平均式量M=$\frac{m}{n}$变小,故答案为:变小;变小;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O;故答案为:CH3OCH3+16OH-12e-=2CO2-3+11H2O,
(4)电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色,当燃料电池消耗2.8LO2(标准状况下)物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,电极反应为O2+2H2O+4e-=4OH-,电子转移为0.5mol,电解池中 阳极电极反应为4OH--4e-=2H2O+O2↑,依据电子守恒溶液中减少氢氧根离子物质的量和增加的氢离子物质的量守恒,则溶液中氢离子浓度=$\frac{0.5mol}{0.5L}$=1mol/L,此时NaCl溶液的pH=14;
故答案为:Y电极附近溶液中有气体产生,上部分呈黄绿色;14.
点评 本题考查了热化学方程式的书写方法和燃烧热概念,盖斯定律的计算应用,原电池反应、电解池反应原理的应用判断,掌握实质是解题关键,题目难度中等.

(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
| A. | -488.3 kJ•mol-1 | B. | -191 kJ•mol-1 | ||
| C. | -476.8 kJ•mol-1 | D. | -1 549.6 kJ•mol-1 |
| A. | 绿色化学的核心是应用化学原理治理环境污染 | |
| B. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| C. | 化妆品中的“天然植物精华”在提取过程中可能用到化学中的萃取、蒸馏技术 | |
| D. | 苯是重要化工原料,被英国科学家法拉第首先发现,以煤和石油为原料通过化学变化均可得到苯 |
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 该反应的反应热等于E1-E2 | |
| C. | 催化剂能改变该反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
| A. | 原子半径:r(D)>r(F)>r(A) | |
| B. | D与C也能形成D2C和D2C2化合物,两种化合物中阳离子和阴离子个数比都为2:1 | |
| C. | 把2mol D的单质投入足量的水中,产生的气体体积为22.4L | |
| D. | 由A、B、C三种元素组成的18电子微粒能发生氧化反应 |
| A. | 将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变 | |
| D. | 向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
 某化学兴趣小组在实验室用如下装置制备氯气.
某化学兴趣小组在实验室用如下装置制备氯气.
