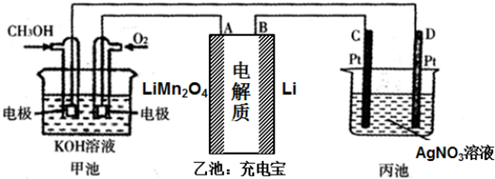
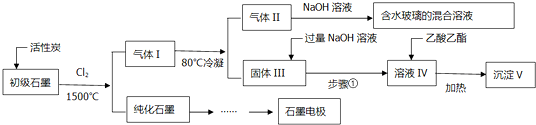
题目内容
6.室温下,浓度均为0.5mol•L-1相同体积的下列四种溶液,其中所含阳离子数由多到少的顺序是( )①KCl ②FeCl3③HF ④Na2CO3.
| A. | ④>①=②>③ | B. | ①>④>②>③ | C. | ④>①>③>② | D. | ④>②>①>③ |
分析 假设溶液体积为1L,分别计算溶液中溶质的物质的量,然后依据强电解质完全电离,弱电解质部分电离,弱碱阳离子、弱酸根离子部分水解的性质判断解答.
解答 解:假设溶液体积为1L,浓度均为0.5mol•L-1相同体积的下列四种溶液,
含有KCl 物质的量为0.5mol,氯化钾为强电解质,完全电离所以含有钾离子物质的量为0.5mol;
含有FeCl3物质的量为0.5mol,氯化铁为强电解质完全电离产生0.5mol三价铁离子,铁离子为弱碱阳离子,部分水解,所以溶液中三价铁离子水解:Fe3++3OH-?Fe(OH)3+3H+,所以阳离子物质的量大于0.5mol;
含有HF物质的量为0.5mol,HF为弱电解质,部分电离,所以含有的氢离子小于0.5mol;
含有碳酸钠的物质的量为0.5mol,碳酸钠为强电解质完全电离,产生1mol钠离子,所以含有阳离子物质的量为1mol;
所以:上述溶液中含有阳离子数目由多到少的顺序为:④>②>①>③;
故选:D.
点评 本题考查了离子浓度大小比较,明确电解质强弱及电离方式,熟悉盐类水解规律是解题关键,题目难度不大.

练习册系列答案
相关题目
3.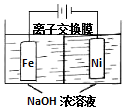 具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
 具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )| A. | 电解一段时间后,阳极室的c(OH-)增大 | |
| B. | Na+由阴极室移向阳极室 | |
| C. | 阴极反应式:2H2O+2e-=H2↑+2OH- | |
| D. | 电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2 |
14.通过实验、观察、类比、推理等方法得出正确的结论是学习化学的方法之一,对下列现象的推断或解释不正确的是( )
| 现象 | 解释或结论 | |
| A | 无色试剂瓶中的浓硝酸呈现黄色 | 硝酸不稳定,分解生成NO2的溶解在其中 |
| B | 在玻璃导管口点燃氢气,火焰呈黄色 | 氢气燃烧 |
| C | 某无色溶液中滴加氯水和四氯化碳,振荡、静置,下层出现紫色 | 溶液中含有碘离子 |
| D | 向CuSO4溶液中通入H2S,有黑色沉淀生成 | 有难溶的CuS生成 |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法中,正确的是( )
| A. | 等浓度CH3COOH溶液与NH3•H2O溶液等体积混合后,存在c(NH4+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 等浓度的HCl溶液与CH3COOH溶液中c(H+)也相同 | |
| C. | 向20mLHCl溶液中加入10mL同一浓度的HCl溶液时,其pH会改变 | |
| D. | 等浓度的CH3COOH溶液和NaOH溶液等体积混合后,溶液显中性 |
15.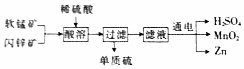 工业上可用软锰矿(主要成分MnO2)和闪锌矿(主要成分为ZnS)制备干电池中所需的MnO2和Zn,其工艺流程如图所示,下列说法中错误的是( )
工业上可用软锰矿(主要成分MnO2)和闪锌矿(主要成分为ZnS)制备干电池中所需的MnO2和Zn,其工艺流程如图所示,下列说法中错误的是( )
 工业上可用软锰矿(主要成分MnO2)和闪锌矿(主要成分为ZnS)制备干电池中所需的MnO2和Zn,其工艺流程如图所示,下列说法中错误的是( )
工业上可用软锰矿(主要成分MnO2)和闪锌矿(主要成分为ZnS)制备干电池中所需的MnO2和Zn,其工艺流程如图所示,下列说法中错误的是( )| A. | 上述流程中锰元素的价态没有变化 | |
| B. | 上述流程中的硫酸可循环利用 | |
| C. | 通电过程中,生成Zn单质时发生还原反应 | |
| D. | 通电过程中,阳极的电极反应式为Mn2+-2e-+2H2O═MnO2+4H+ |
16.已知A、B、C、D是短周期中原子序数依次增大的四种主族元素.A2在常温下呈气态,B原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显碱性 |
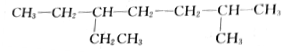 的名称是2-甲基-5-乙基庚烷
的名称是2-甲基-5-乙基庚烷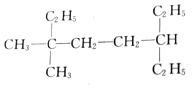 的名称是3,3-二甲基-6-乙基辛烷
的名称是3,3-二甲基-6-乙基辛烷 的名称是2-甲基-3,6-二乙基辛烷
的名称是2-甲基-3,6-二乙基辛烷 的名称是2,4,4,5-四甲基庚烷.
的名称是2,4,4,5-四甲基庚烷.