题目内容
14.通过实验、观察、类比、推理等方法得出正确的结论是学习化学的方法之一,对下列现象的推断或解释不正确的是( )| 现象 | 解释或结论 | |
| A | 无色试剂瓶中的浓硝酸呈现黄色 | 硝酸不稳定,分解生成NO2的溶解在其中 |
| B | 在玻璃导管口点燃氢气,火焰呈黄色 | 氢气燃烧 |
| C | 某无色溶液中滴加氯水和四氯化碳,振荡、静置,下层出现紫色 | 溶液中含有碘离子 |
| D | 向CuSO4溶液中通入H2S,有黑色沉淀生成 | 有难溶的CuS生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.由于浓硝酸部分水解生成红棕色的二氧化氮,则浓硝酸呈现黄色;
B.氢气燃烧时的颜色为淡蓝色,呈黄色是钠元素的焰色反应的火焰颜色;
C.紫色为碘单质,氯水具有强氧化性,能够将碘离子氧化成碘单质;
D.硫化铜为难溶于硫酸的黑色沉淀.
解答 解:A.硝酸不稳定,分解生成的NO2溶解在溶液中,导致无色试剂瓶中的浓硝酸呈现黄色,故A正确;
B.在普通玻璃导管口点燃纯净氢气时,火焰呈黄色,是因为玻璃中有钠元素,点燃时发出的焰色是钠元素的焰色黄色,氢气燃烧时的火焰颜色为淡蓝色,故B错误;
C.某无色溶液中滴加氯水和四氯化碳,振荡、静置,下层出现紫色,说明又碘单质生成,证明溶液中含有碘离子,故C正确;
D.CuS难溶于硫酸,向CuSO4溶液中通入H2S,会有黑色的CuS沉淀生成,故D正确;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及氢气燃烧、氧化还原反应、硫化铜性质等知识,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
相关题目
11.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 漂白粉的成分为次氯酸钙和氯化钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 浓硫酸具有强氧化性,所以浓硫酸可用于干燥H2和CO2 |
9.下列各组离子能在溶液中大量共存的是( )
| A. | Fe3+、Cu2+、NO3-、S2- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | Fe3+、K+、Cl-、I- | D. | Fe2+、Fe3+、Cu2+、Cl- |
19.硫酸铵溶液中离子浓度关系不正确的是( )
| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(NH4+)=2c(SO42-) | ||
| C. | c(NH4+)+c(NH3•H2O)=2c(SO42-) | D. | c(NH4+)+c(H+)=c(OH-)+2c(SO42-) |
6.室温下,浓度均为0.5mol•L-1相同体积的下列四种溶液,其中所含阳离子数由多到少的顺序是( )
①KCl ②FeCl3③HF ④Na2CO3.
①KCl ②FeCl3③HF ④Na2CO3.
| A. | ④>①=②>③ | B. | ①>④>②>③ | C. | ④>①>③>② | D. | ④>②>①>③ |
3.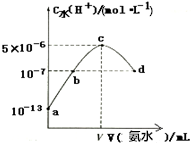 常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )
常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )
 常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )
常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )| A. | 该硫酸的浓度为1mol•L-1 | |
| B. | b点所示溶液中:c(NH4+)=2c(SO42-) | |
| C. | V=40 | |
| D. | c点所示溶液中:c(H+)-c(OH-)═c(NH3•H2O) |
4.在恒温恒容密闭容器中充入0.5molN2和1.5molH2发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol充分反应后,下列说法正确的是( )
| A. | 在和上面初始体积相同的恒温恒压密闭容器中,也充入0.5molN2和1.5molH2发生反应则达到平衡时,放出的热量大于46.2kJ | |
| B. | 在平衡时再充入1molNH3则平衡向左移动,则平衡时N2的百分含量减小 | |
| C. | 若向容器中充入一定量He气,则平衡向右移动 | |
| D. | 在平衡后再充入1molH2,则N2的转化率增大,且平衡常数增大 |
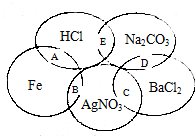 如图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题: