题目内容
19.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: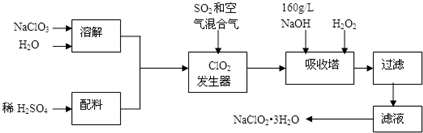
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下.
(1)发生器中发生反应的离子方程式为2ClO3-+SO2=2ClO2+SO42-.发生器中鼓入空气的作用可能是c.
a.将SO2氧化成SO3,增强酸性 b.将NaClO3还原为ClO2 c.稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;吸收塔内的温度不能超过20℃,其目的是防止H2O2分解.
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中.以下还可以选择的还原剂是a(选填序号).
a.Na2O2 b.Na2S c.FeCl2
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是蒸发浓缩、冷却结晶、过滤.
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250ml待测溶液.
(已知:ClO2-+4I-+4H+═2H2O+2I2+Cl-)
b.移取25.00ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol•L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml.(已知:I2+2S2O32-═2I-+S4O62-)
①达到滴定终点时的现象为滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色.
②该样品中NaClO2的质量分数为$\frac{22.625cV}{m}$%(用含m、c、V的代数式表示,结果化成最简.)
分析 由制备实验流程可知,固体溶解后与酸混合,在发生器内发生氧化还原反应生成ClO2和Na2SO4,在吸收塔内发生2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O,
(1)ClO2发生器中NaClO3与SO2发生氧化还原反应生成ClO2和Na2SO4;由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.据此解答;
(2)根据题目信息并运用氧化还原反应理论判断反应物、生成物;根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,据此书写方程式;温度过高,H2O2容易分解;
(3)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体;
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
②由反应中的I元素守恒可知:ClO2-~2I2~4 S2O32-,25.00mL待测溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,计算得到NaClO2的质量分数.
解答 解:(1)ClO2发生器中NaClO3与SO2发生氧化还原反应生成ClO2和Na2SO4,其反应的离子方程式为:2ClO3-+SO2=2ClO2+SO42-;
由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,
故答案为:2ClO3-+SO2=2ClO2+SO42-;c;
(2)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;
H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;防止H2O2分解;
(3)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2;Na2S、FeCl2还原性较强,而生成物与NaClO2分离比较困难,
故答案为:a;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,
故答案为:蒸发浓缩、冷却结晶、过滤;
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
故答案为:滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
②由反应中的I元素守恒可知:ClO2-~2I2~4 S2O32-,25.00mL待测溶液中n(NaClO2)=$\frac{1}{4}$×cV×10-3mol,m(NaClO2)=$\frac{1}{4}$×90.5cV×10-3g;样品mg配成250mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为$\frac{\frac{1}{4}×90.5cV×1{0}^{-2}g}{mg}$×100%=$\frac{22.625cV}{m}$%,
故答案为:$\frac{22.625cV}{m}$%.
点评 本题考查物质的制备实验,为高频考点,把握物质的性质、发生的反应、混合物分离及关系式计算为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的标准燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 稀硫酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(g)=FeS(s)△H=-95.6 kJ•mol-1 |
(1)易溶于乙醇和水,微溶于乙醚(易挥发),难溶于苯和四氯化碳.
(2)草酸具有很强的还原性
请跟据以上信息回答下列问题:
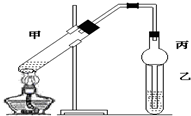
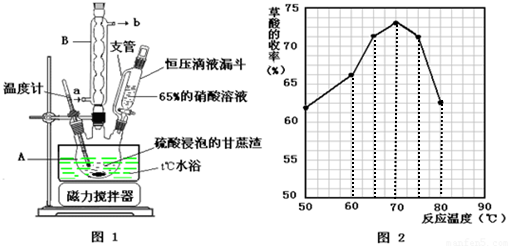
(1)氧化-水解过程是在上图1的装置中进行的,指出装置A的名称三颈烧瓶.
(2)氧化-水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸产率的影响,结果如上图2所示,请选择最佳的反应温度为70℃,实验中若混酸滴加过快或温度过高,将导致草酸产率下降,其原因是草酸易被浓硫酸或硝酸氧化.
(3)得到粗产品后,洗涤时选择乙醚 作洗涤剂,理由是易挥发,无残留.
(4)为了确定产品中H2C2O4•2H2O(M=126g/mol)的纯度,称取10.0g草酸样品,配成250mL溶液,每次实验时准确量取25.00mL草酸溶液,加入适量的稀硫酸,用0.1mol/LKMnO4标准溶液滴定.平行滴定三次,重复滴定三次,每次消耗KMnO4标准溶液的体积如下表所示
| 第一次 | 第二次 | 第三次 | |
| 体积(mL) | 16.10mL | 16.60mL | 15.90mL |
②在草酸纯度测定的实验过程中,下列说法正确的是:CD.
A.配制标准液时,若KMnO4不纯(杂质不与待测液反应),会使实验误差偏低
B.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
C.滴定时,眼睛注视锥形瓶,观察溶液颜色变化
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色.
④草酸晶体的纯度为50.4%.

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的两种仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(3)调节溶液PH为2~3的目的是防止在浓缩结晶过程中Ni2+水解.
(4)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.(回答一点即可)
(5)现有100千克含镍催化剂,如果酸浸步骤镍浸出率为a%,其它物质全部参与反应,且假定镍在酸浸后续步骤无损失.操作C后粗晶体中含绿矾b%,则最终能得到粗晶体$\frac{100×64.4%×a%×281}{(1-b%)×59}$千克(Ni-59 NiSO4•7H2O-281)(只要求写出计算表达式).若要进一步提纯晶体,需进行的操作是重结晶.
| A. | 取100mL5mol/LH2SO4,加入400mL水 | |
| B. | 取200mL5mol/LHCl,加水稀释至500mL | |
| C. | 取200 mL5mol/LH2SO4,加水稀释至500mL | |
| D. | 取100 mL5mol/LHNO3,加水稀释至500mL |
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- | |
| D. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- |

 +CaCl2+H2O,该反应的原子利用率25.4%.
+CaCl2+H2O,该反应的原子利用率25.4%.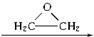 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH