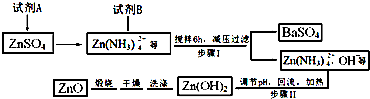
题目内容
1.有关热化学方程式书写与对应表述均正确的是( )| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的标准燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 稀硫酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(g)=FeS(s)△H=-95.6 kJ•mol-1 |
分析 A.碳的燃烧热中生成氧化物应该为二氧化碳;
B.反应热与化学计量数成正比,焓变数值错误;
C.稀的强酸与稀的强碱溶液反应生成1mol水放出的热量为中和热;
D.S的状态错误,硫粉为固体.
解答 解:A.2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,反应中碳不完全燃烧,则C的标准燃烧热大于110.5 kJ•mol-1,故A错误;
B.在101KPa下氢气的标准燃烧热△H=-285.5 kJ•mol-1,水分解的焓变数值错误,则水分解的正确的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571 kJ•mol-1,故B错误;
C.稀硫酸与0.1 mol/LNaOH溶液反应,该反应为中和反应,其反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,故C正确;
D.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,硫粉的状态为固体,正确的热化学方程式为:Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1,故D错误;
故选C.
点评 本题考查了热化学方程式的书写及判断,题目难度中等,明确燃烧热、中和热的概念为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12.H2和 I2在一定条件下能发生反应:H2(g)+I2(g) 2HI(g)△H=-a kJ/mol
已知: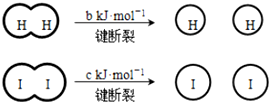 (a、b、c均大于零) 下列说法不正确的是( )
(a、b、c均大于零) 下列说法不正确的是( )
已知:
 (a、b、c均大于零) 下列说法不正确的是( )
(a、b、c均大于零) 下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开 1 mol H-H 键和1 mol I-I键所需能量大于断开 2 mol H-I键所需能量 | |
| C. | 断开 2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于 2a kJ |
9.下列说法不正确的是( )
| A. | 物质发生化学反应都伴随着能量的变化,伴有能量变化的物质变化都是化学变化 | |
| B. | 101kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,H2(g)的燃烧热为285.8kJ•mol-1 | |
| C. | 在相同条件下的稀溶液中,1molHCl、1molHNO3分别与足量NaOH充分反应,放出的热量相等 | |
| D. | H2+Cl2═2HCl的能量变化情况可用如图表示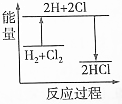 |
16.实验室在配制硫酸亚铁溶液时,先把硫酸亚铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是( )
| A. | 提高硫酸亚铁的溶解度 | B. | 防止硫酸亚铁分解 | ||
| C. | 抑制硫酸亚铁水解 | D. | 稀硫酸防止硫酸亚铁被氧化 |
13.下列说法正确的是( )
| A. | 电子从3s能级跃迁到3p能级形成的光谱是发射光谱 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为109°28′ | |
| C. | NO2- 中心原子采取sp2杂化,分子空间构型为“V”形 | |
| D. | 原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |