题目内容
17.研究化学反应的快慢和限度对工业生产具有重要意义.请回答下列问题:
(1)2SO2(g)+O2(g)?2SO3(g)是工业制备硫酸的重要一步反应.一定温度下的恒容容器中,使用V2O5催化剂时,逆反应的速率增大(填“增大”、“不变”、“减小”);该反应达平衡状态时,向容器中充入惰性气体,容器内的压强增大(同上),此时正反应速率不变(同上);在t1、t2时刻,SO3(g)的浓度分别为c1、c2,则时间间隔t1至t2内,SO3(g)生成的反应速率表达式为$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$.
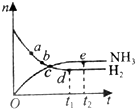
(2)合成氨工业对国民经济和社会发展具有重要意义.密闭容器中,在400℃、30MPa条件下,反应N2(g)+3H2(g)?2NH3(g)的n(NH3)、n(H2)随时间变化的关系如图所示.
①能够表明该反应达平衡状态的点是de;
②a点正反应速率和逆反应速率的关系是:v(正)>v(逆)(填“>”、“=”或“<”)
③点d(t1时刻)和点e(t2时刻)处的n(N2)的大小关系为等于.(填“大于”、“等于”或“小于”)
分析 (1)催化剂能同等程度的改变正逆反应速率,恒容条件下,该反应达平衡状态时,向容器中充入惰性气体,容器内的压强增大,但正逆反应速率不改变,平衡不移动;
v=$\frac{△c}{△t}$;
(2)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变;
②根据图知,de点达到平衡状态,则a点平衡向正反应方向移动,平衡向哪个方向移动,则该方向的反应速率较大;
③点d(t1时刻)和点e(t2时刻)处都是平衡状态,平衡状态时各物质的物质的量不变.
解答 解:(1)催化剂能同等程度的改变正逆反应速率,正催化剂加快反应速率,所以使用V2O5催化剂时,逆反应的速率增大;
恒容条件下,气体的物质的量之比等于压强之比,所以该反应达平衡状态时,向容器中充入惰性气体,容器内的压强增大;
但反应物和生成物浓度不变,所以正逆反应速率不改变,平衡不移动;
v=$\frac{△c}{△t}$=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$,
故答案为:增大;增大;不变;$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$;
(2)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,根据图知,de点各物质的物质的量不变,所以该反应达到平衡状态,故答案为:de;
②根据图知,de点达到平衡状态,则a点平衡向正反应方向移动,平衡向哪个方向移动,则该方向的反应速率较大,所以该点正反应速率大于逆反应速率,故答案为:>;
③点d(t1时刻)和点e(t2时刻)处都是平衡状态,平衡状态时各物质的物质的量不变,所以点d(t1时刻)和点e(t2时刻)处的n(N2)相等,故答案为:等于.
点评 本题考查图象分析及化学平衡状态影响因素,为高频考点,侧重考查学生分析判断能力,注意:只有能引起物质浓度改变的压强改变才能影响平衡移动,否则平衡不移动,注意“恒温恒容条件下加入稀有气体和恒温恒压条件下加入稀有气体”的区别,为易错点.

 阅读快车系列答案
阅读快车系列答案【猜想】猜想1:可以减少汽车尾气的污染;
猜想2:可以产生更多的热量,增强汽车的动力.
【设计与实验】
| 序号 | 实验步骤 | 实验现象 | 结论 |
| Ⅰ | 在两个蒸发皿中各加入10mL冷水,控制相同燃烧条件,分别用乙醇和汽油作为燃料进行加热,记录从开始到水沸腾的时间. | 用乙醇加热耗时118s;用汽油加热耗时56s. | 猜想2不成立 (填“成立”或“不成立”) |
| Ⅱ | 实验Ⅰ停止加热后,取下蒸发皿,观察蒸发皿的底部. | 用乙醇加热的蒸发皿底部只有及少量炭黑,而用汽油加热的蒸发皿底部有大量的炭黑. | 猜想1成立(可仿照上格填写) |
(1)实验Ⅰ是一个对比实验,实验过程中不一定控制的条件是B(填序号);
A.水的初始温度必须相同 B.加热开始计时点必须相同
C.燃具产生火焰的大小必须相同 D.蒸发皿的大小必须相同
(2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将减少;
(3)目前乙醇汽油中乙醇的添加量约为10%,可一定程度节省石油资源.结合实验Ⅰ的结论分析,如果乙醇的添加量过大,会使汽车动力减弱(填“增强”“减弱”“不变”).
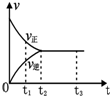 如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正反应在不断进行,速率在逐渐减小 | |
| B. | t2时,反应到达限度,在此条件下N2的转化率达到最大 | |
| C. | t2-t3,反应不再发生,各物质的物质的量保持恒定 | |
| D. | t3以后,N2(g)、H2(g)、NH3(g)的物质的量浓度相等 |
2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加 NH3 的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗 NO 和 N2 的物质的量比为 1:2 时,反应达到平衡 |
 钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:
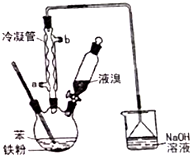 溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去)
溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去) +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.
+HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.