题目内容
18.有一瓶无色澄清溶液,其中可能含有H+、K+、Mg2+、Ba2+、Cl-、SO42-、CO32-、MnO4-离子.现进行以下实验:(1)用pH试纸检验溶液,发现溶液呈强酸性;
(2)取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
(3)取少量(2)中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生.
①根据上述事实确定:该溶液中肯定存在的离子有H+、Ba2+、Cl-;肯定不存在的离子有Mg2+、SO42-、CO32-、MnO4-;可能存在的离子有K+.
②写出(3)中发生反应的离子方程式Ba2++CO32-═BaCO3↓.
分析 由无色可知一定不含MnO4-,
(1)用pH试纸检验溶液,发现溶液呈强酸性,则一定含H+,不存在CO32-;
(2)取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Mg2+,;
(3)取少量(2)中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,沉淀为碳酸钡,则一定含Ba2+,不能存在SO42-,结合电荷守恒来解答.
解答 解:由无色可知一定不含MnO4-,
(1)用pH试纸检验溶液,发现溶液呈强酸性,则一定含H+,不存在CO32-;
(2)取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Mg2+,;
(3)取少量(2)中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,沉淀为碳酸钡,则一定含Ba2+,不能存在SO42-,
溶液不显电性,一定含阴离子为Cl-,
①综上所述,肯定存在:H+、Ba2+、Cl-;肯定不存在:Mg2+、SO42-、CO32-、MnO4-;可能存在:K+,
故答案为:H+、Ba2+、Cl-;Mg2+、SO42-、CO32-、MnO4-;K+;
②(3)中发生反应的离子方程式为Ba2++CO32-═BaCO3↓,
故答案为:Ba2++CO32-═BaCO3↓.
点评 本题考查无机物的推断,为高频考点,把握离子之间的反应、现象推断离子为解答的关键,侧重分析与推断能力的考查,注意沉淀及电荷守恒的判断,题目难度不大.

练习册系列答案
相关题目
8.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH•H2O═AlO2-+4NH4++2H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
9.下列有关混合物、纯净物、电解质、非电解质的正确组合为( )
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
7.下列物质能通过化合反应直接制得的是( )
①FeCl2 ②CuO③CO④Cu2S⑤Na2O2⑥MgCl2⑦A1Cl3⑧NaHCO3⑨FeCl3⑩Fe(OH)3.
①FeCl2 ②CuO③CO④Cu2S⑤Na2O2⑥MgCl2⑦A1Cl3⑧NaHCO3⑨FeCl3⑩Fe(OH)3.
| A. | 只有①②③④⑦ | B. | 只有⑤⑥⑧⑨⑩ | C. | 只有①③⑤⑦⑨ | D. | 全部 |
 用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:
用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答: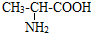 .
.