题目内容
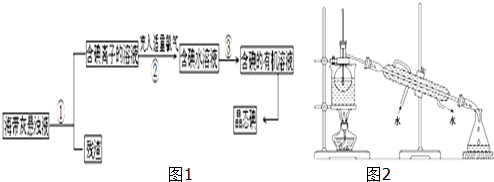
2.纯碱(Na2CO3)在生产生活中具有广泛的用途.以下是实验室模拟侯氏制碱原理制取Na2CO3的流程图.
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NH3+H2O+CO2+NaCl═NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等.精制除杂的步骤顺序是acdeb(填编号);
a.粗盐溶解,滤去沉渣b.加入盐酸调pHc.加入Ba(OH)2溶液
d.加入Na2CO3溶液e.过滤
(2)灼烧固体A制Na2CO3在坩埚(填仪器名称)中进行.证明滤液A中含有NH4+的方法是取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;对滤液A进行重结晶能够获得NH4HCO3,NH4HCO3是一种常用的溶液pH调节剂.向pH=13含Na+、K+的溶液中加入少量NH4HCO3使pH降低,反应的离子方程式为NH4++HCO3-+2OH-=NH3•H2O+CO32-+H2O.
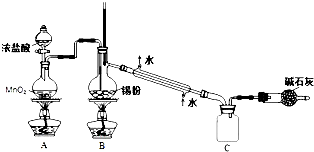
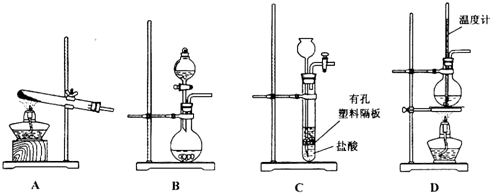
(3)如图装置中用于制备CO2的是BC(填编号);用B示意的装置制备NH3,分液漏斗中盛放的试剂是浓氨水,烧瓶内可加入的固体试剂是碱石灰或生石灰.
(4)一种天然碱晶体成分是aNa2CO3•bNa2SO4•cH2O,请从提供的试剂中选择必要的试剂设计简单实验方案测定Na2CO3的质量分数.(仪器自选)用天平称取一定质量的晶体样品,加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,过滤,洗涤,干燥,称量沉淀并计算.
供选择的试剂:2mol•L-1盐酸、0.5mol•L-1CaCl2溶液、稀氨水、碱石灰、澄清石灰水(足量)、1mol•L-1H2SO4溶液.
分析 (1)根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)根据固体在坩埚加热分解;
根据NH4+的检验方法:取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;
NH4+和HCO3-都能与氢氧根离子反应;
(3)实验室制取二氧化碳的反应原理和条件;根据在浓氨水中加碱石灰或生石灰,因为氨水中存在下列平衡:NH3+H2O?NH3•H2O?NH4++OH-加入碱石灰或生石灰溶于水产生氢氧根离子平衡左移,同时放出大量的热促进氨水的挥发,制得氨气;
(4)根据实验的原理:先称取一定量的天然碱晶体并溶解得到水溶液,将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数.
解答 解:(1)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、Ba(OH)2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,故答案为:acdeb;
(2)灼烧固体碳酸氢钠制Na2CO3,在坩埚加热分解,取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+,NH4+和HCO3-都能与氢氧化钠反应:NH4++HCO3-+2OH-=NH3•H2O+CO32-+H2O;
故答案为:坩埚;取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;NH4++HCO3-+2OH-=NH3•H2O+CO32-+H2O;
(3)实验室制取二氧化碳常选用石灰石和稀盐酸或大理石和稀盐酸反应制取,采用固体+液体$\stackrel{不加热}{→}$气体,故选BC;浓氨水中加碱石灰或生石灰,因为氨水中存在下列平衡:NH3+H2O?NH3•H2O?NH4++OH-,加入碱石灰或生石灰溶于水产生氢氧根离子平衡左移,同时放出大量的热促进氨水的挥发,制得氨气,所以分液漏斗中盛放的试剂是浓氨水,烧瓶内可加入的固体试剂是碱石灰或生石灰,故答案为:BC;浓氨水;碱石灰或生石灰;
(4)实验的原理:先称取样品质量并溶解,将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数,所以将天然碱晶体样品,溶于适量蒸馏水中,加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,然后过滤、洗涤、干燥、称量沉淀即可,
故答案为:用天平称取一定质量的晶体样品,加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,过滤,洗涤,干燥,称量沉淀并计算.
点评 本题以制碱原理制取Na2CO3,涉及到物质的除杂和提纯,常见的实验操作,物质的制备等,难度中等,培养了学生运用知识的能力.

 名校课堂系列答案
名校课堂系列答案 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O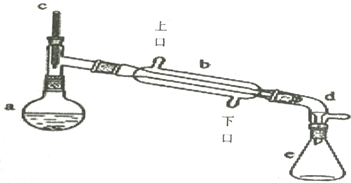
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是冷凝管
(2)加入碎瓷片的作用是防暴沸.
(3)在本实验分离过程中,产物应该从分液漏斗的A
A.上口倒出 B.下口放出
(4)在本实验合成反应过程中,b中如何通入冷却水B
A.上口流进下口流出 B.下口流进上口流出
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.圆底烧瓶 B.温度计 C.蒸发皿 D.酒精灯 E.接收器
(6)分离提纯过程中加入无水氧化钙的目是除水
(7)本实验中最容易产生的副产物的结构简式为

(8)本实验所得到的环己烯产率是61%(结果化成百分数).
| A. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大 | |
| B. | 结构式为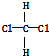 和 和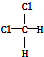 的物质互为同分异构体 的物质互为同分异构体 | |
| C. | 根据反应:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3>HA>HCO3->HB | |
| D. | 过硼酸钠晶体(NaBO3•4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3•H2O |
 甲苯(
甲苯(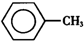 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(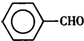 )、苯甲酸(
)、苯甲酸(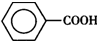 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
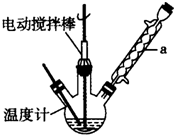
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶
中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过 氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为
 ,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
d.加入适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.【苯甲酸相对分子质量:122.0】
| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
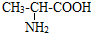 .
.