题目内容
3.工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3).其工业流程如图1下: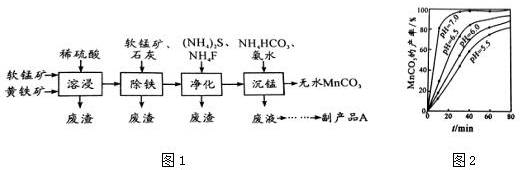
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解.
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)=1.46×10-6mol/L〔已知:Ksp(CaF2)=1.46×10-10〕
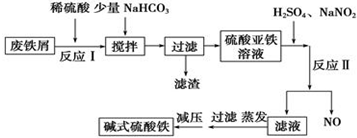
(2)沉锰工序中,298K、c(Mn2+)为1.05mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图2所示.根据图中信息得出的结论是pH等于7.0时反应速率最快,且MnCO3的产率最高.
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥).
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol•L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应.
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+═Mn2++2CO2↑+2H2O
求该软锰矿中二氧化锰的质量分数72.5%(写出计算过程).
分析 由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液pH,FeS2和稀硫酸反应生成Fe2+,然后过滤得到滤渣是MnO2,向滤液中加入软锰矿发生的离子反应方程式为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,过滤,滤液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,通过洗涤、烘干得到MnCO3晶体,
(1)根据Ksp(CaF2)和c(F-),写出溶度积常数表达式求算钙离子浓度;
(2)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(3)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可得到碳酸锰;
(4)n(C2O42-)=2.68g÷134g/mol=0.02mol;
滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×10=0.00400mol;
根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.00400mol×5=0.0200mol×2,
n(MnO2)=0.0100mol,再根据质量分数公式计算其质量分数.
解答 解:由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液pH,FeS2和稀硫酸反应生成Fe2+,然后过滤得到滤渣是MnO2,向滤液中加入软锰矿发生的离子反应方程式为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,过滤,滤液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,通过洗涤、烘干得到MnCO3晶体,
(1)已知Ksp(CaF2))=1.46×10-10,c(F-)=0.01 mol•L-1 ,则c(Ca2+)=$\frac{{K}_{sp}}{{c}^{2}({F}^{-})}$=$\frac{1.46×1{0}^{-10}}{0.0{1}^{2}}$mol/L=1.46×10-6mol•L-1,
故答案为:1.46×10-6 mol/L;
(2)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高;
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥),用水洗去可溶性杂质,用乙醇洗去水分,低温干燥防止碳酸锰分解,
故答案为:先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥);
(4)n(C2O42-)=2.68g÷134g/mol=0.02mol;
滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×10=0.00400mol;
根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.00400mol×5=0.0200mol×2,
n(MnO2)=0.0100mol,
二氧化锰质量分数=$\frac{0.0100mol×87g/mol}{1.20g}$×100%=72.5%,
故答案为:72.5%.
点评 本题考查物质制备,为高频考点,涉及方程式的计算、溶度积常数计算、物质分离和提纯操作、图象分析等知识点,侧重考查学生分析、计算能力,难点是(4)题计算,注意转移电子守恒的应用.

部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围4.4-7.5
②写出可能发生的离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂;若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol
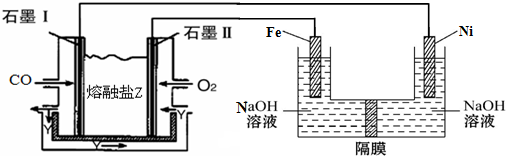
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)42+,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+
(4)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸盐Na2FeO4的装置如图所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式CO+CO32--2e-=2CO2
写出电解池中生成FeO42-的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
CO:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
丙烷:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ/mol
正丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=-2878.0kJ/mol
异丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l)△H=-2869.6kJ/mol
下列有关说法正确的是( )
| A. | 常温下,正丁烷的燃烧热为-2878.0 kJ/mol | |
| B. | 相同质量的丙烷和丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 | |
| C. | 常温下,CO的燃烧热为566.0 kJ/mol | |
| D. | 人类利用的能源都是通过化学反应获得的 |
| A. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| B. | SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{{c(N{H_3}•{H_2}O)•c({H^+})}}{{c(N{H_4}^+)}}$增大 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
(1)在锥形瓶中放入一定量的NaOH溶液,加入甲基橙或酚酞作为指示剂;当滴定达到终点后,读取凹液面的最低点所对应的刻度作为终读数
(2)填写表中的空白处
| 实验次数 | V(NaOH) | V (HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.02 | 0.00 | 16.69 | 16.69 | 0.1042 |
| 2 | 16.71 | 0.00 | 17.90 | 17.90 | |
| 3 | 19.52 | 0.00 | 20.79 | 20.79 | 0.1065 |
| 4 | 14.99 | 0.00 | 16.02 | 16.02 | 0.1069 |
A.滴定管未用HCl溶液润洗
B.摇晃锥形瓶时,有液体溅出
C.滴定前装HCl的滴定管下端有气泡,滴定后气泡消失
D.放入NaOH溶液前,锥形瓶内有水
(4)计算NaOH浓度平均值:0.1068mol/L.
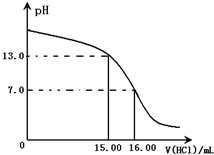 Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图).
Ⅰ.某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL某浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线(如图).由上图可知NaOH溶液的物质的量浓度为4.0mol/L(忽略溶液混合时体积和温度的变化)
Ⅱ.该小组四位同学在做实验时,发现了一个意外现象:向上述NaOH溶液中滴入酚酞溶液,开始时溶液变红,一会儿红色就消失了.对此意外现象形成的原因,该小组同学分别提出了各自的看法并进行相应的实验设计.
[猜想]甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度的大小有关.
[理论分析]
(1)丙同学认为乙同学的猜想也不正确,他的理由是NaOH与空气中的CO2反应后的产物是碳酸钠,碳酸钠溶液显碱性,也可使酚酞试剂变红
[实验设计]
(2)为证实丙同学的猜想,还需做如下实验,请完成下表:
| 实验步骤 | 设计这一步骤的目的 |
| (1)将配制的氢氧化钠溶液加热 | ① |
| (2)在加热后的溶液中滴加酚酞,并在上方滴一些植物油 | ②利用植物油隔绝空气 |
| 实验方法 | 观察到的现象 | 结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液. | 浓度大的溶液中红色会消失 | 红色消失与氢氧化钠溶液的浓度大小有关 |
| 方案二:向原红色消失的溶液中加 ①(填试剂名称) | ② |
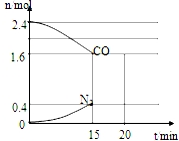 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:


