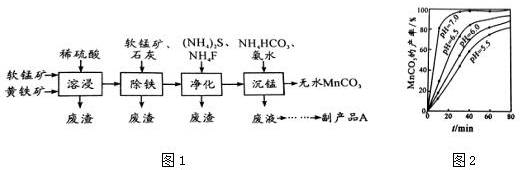
题目内容
12.按要求填空.(1)浓度均为0.1mol/L的①硫酸②醋酸③氢氧化钠④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是④>②>③>①(填序号).
(2)Fe2(SO4)3溶液显酸性,用离子方程式表示其原因Fe3++3H2O?Fe(OH)3+3H+.
(3)AlCl3溶液和NaAlO2溶液混合的化学方程式为AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl.
(4)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有出现红褐色沉淀,同时有无色无味气体产生.
(5)常温下,将0.2mol/L CH3COOH和0.1mol/LNaOH溶液等体积混合,所得溶液的pH<7,该混合溶液中离子浓度由大到小的顺序是C(HCOO-)>C(Na+)>C(H+)>C(OH-).
分析 (1)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(2)Fe2(SO4)3为强酸弱碱盐,水解呈酸性,并生成氢氧化铁;
(3)AlCl3溶液和NaAlO2溶液发生互促水解反应;
(4)FeCl3水解呈酸性,可使碳酸钙溶解;
(5)将O.4mol/L CH3COOH溶液和 O.2mol/LNaOH溶液各1OOmL混合后,溶质为等浓度的醋酸和醋酸钠,溶液显示酸性,则醋酸的电离程度大于醋酸根离子的水解,然后结合电荷守恒判断溶液中各离子浓度大小.
解答 解:(1)④氯化铵为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④>②>③>①;
(2)Fe2(SO4)3为强酸弱碱盐,水解呈酸性,并生成氢氧化铁,离子方程式为Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(3)AlCl3溶液和NaAlO2溶液发生互促水解反应,生成氢氧化铝沉淀,方程式为AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,
故答案为:AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl;
(4)氯化铁水解呈酸性,Fe3++3H2O?Fe(OH)3+3H+,可使碳酸钙溶解,反应的方程式为CaCO3+2H+=Ca2++H2O+CO2↑,反应消耗H+,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,溶液颜色变深或溶液为红褐色或久置有红褐色沉淀,
故答案为:出现红褐色沉淀,同时有无色无味气体产生;
(5)酸的物质的量是碱的物质的量的2倍,且酸碱都是一元的,反应后生成等物质的量的HCOOH和HCOONa;如果酸电离的程度大于盐水解的程度,溶液呈酸性;HCOOH和HCOONa和醋酸都电离生成醋酸根,且电离大于水解,故该混合溶液中离子浓度由大到小的顺序是:C(HCOO-)>C(Na+)>C(H+)>C(OH-)
故答案为:C(HCOO-)>C(Na+)>C(H+)>C(OH-).
点评 本题综合考查弱电解质的电离以及盐类的水解,为高频考点,侧重于学生的分析能力的考查,注意把握电解质的电离和盐类水解的特点以及影响因素,难度不大.


下列说法正确的是( )
| A. | 由图Ⅰ可知,加入适当的催化剂,E和△H都减小 | |
| B. | 图Ⅱ中0~10 min内该反应的平均速率v(Y2)=0.045 mol•L-1•min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(X2)的变化曲线为d | |
| C. | 图Ⅲ中a、b、c三点所处的平衡状态中,反应物X2的转化率最高的是b点 | |
| D. | 图Ⅲ中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则T1<T2,K1<K2 |
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 平衡后再加入1molSO3,SO2的转化率增大 |
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
(2)请写出反应③的平衡常数表达式K3=K1•K2(用K1、K2表).
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速υ(H2)=0.15mol/(L•min),若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”、“=”).
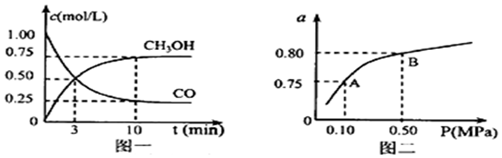
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是D
A.容器中总压强不变
B.混台气体的平均摩尔质量不变
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变.
| A. | 单位时间内生成3n mol X,同时生成n mol Y | |
| B. | 2v逆(Y)=v正(Z) | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
| A. | K随压强的改变而改变 | B. | K越大,C的平衡浓度越小 | ||
| C. | C的起始浓度越大,K值越大 | D. | K越大,反应进行的程度越大 |