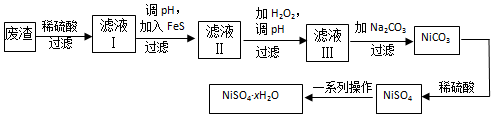
题目内容
7.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| B. | 在25℃、1.01×105 Pa时,11.2 L N2所含的原子数为NA | |
| C. | 18g水中所含的质子数为8NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
分析 A、氖气为单原子分子;
B、在25℃、1.01×105 Pa时,气体摩尔体积大于22.4L/mol;
C、求出水的物质的量,然后根据水中含10个质子来分析;
D、气体单质分为单原子分子、双原子分子和多原子分子.
解答 解:A、氖气为单原子分子,故1mol氖气中含NA个原子,故A正确;
B、在25℃、1.01×105 Pa时,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则含有的原子个数小于NA个,故B错误;
C、18g水的物质的量为1mol,而水中含10个质子,故1mol水中含10NA个质子,故C错误;
D、同温同压下,相同体积的任何气体的物质的量均相同,但由于气体单质分为单原子分子、双原子分子和多原子分子,故相同物质的量的单质气体中含有的原子个数不一定相同,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列叙述中正确的是( )
| A. | 以Al作阳极,Fe作阴极,AlCl3溶液作电解液,可以实现铁上镀铝 | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
17.下列实验操作的描述中,正确的是( )
| A. | 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物 | |
| C. | 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量 | |
| D. | 利用丁达尔效应可以区别溶液和胶体 |
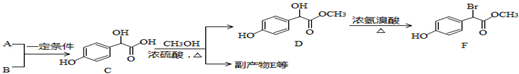
 ;
;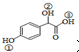 )中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②;
)中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②; .
.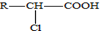 .A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5.
.A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5. 电解饱和食盐水装置的结构如图所示:
电解饱和食盐水装置的结构如图所示: