题目内容
2.铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+,写出该反应的化学方程式2CeO2+H2O2+6H+=2Cr3++O2↑+4H2O ,CeO2在该反应中作氧化剂.
(2)自然界中Cr主要以+3价和+6价存在,+6价的Cr能引起细胞的突变.现用亚硫酸钠溶液与0.1mol K2Cr2O7反应,将其+6价的Cr完全还原为+3价的铬,则消耗1mol/L亚硫酸钠溶液的体积为0.3L.
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是4Na+TiCl4═Ti+4NaCl.
(4)NiSO4•xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质(已知溶解度FeS>CuS).请写出除去Cu2+的离子方程式FeS+Cu2+=CuS+Fe2+.
②对滤液Ⅱ先加H2O2再调pH.加H2O2的目的是氧化Fe2+,调pH的目的是除去Fe3+.
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4).
分析 (1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;结合原子守恒和电荷守恒配平书写离子方程式,利用反应定量关系计算;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,依据原子守恒书写;
(4)电镀废渣(除镍外,还含有铜、锌、铁等元素),过滤后在滤液中加入FeS,生成CuS、ZnS,可除去Cu2+、Zn2+等杂质,对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+生成Fe3+,有利于水解生成氢氧化铁沉淀而除去,过滤后在滤液中加入碳酸钠,可生成NiCO3,过滤后加入硫酸可生成NiSO4,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体,以此解答.
解答 解:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂,反应的离子方程式为2CeO2+H2O2+6H+=2Cr3++O2↑+4H2O,
故答案为:2CeO2+H2O2+6H+=2Cr3++O2↑+4H2O;氧化;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;反应的离子方程式:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,现用亚硫酸钠溶液与0.1mol K2Cr2O7反应,将其+6价的Cr完全还原为+3价的铬,消耗亚硫酸钠物质的量为0.3mol,则消耗1mol/L亚硫酸钠溶液的体积=$\frac{0.3mol}{1mol/L}$=0.3L,
故答案为:0.3;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为:4Na+TiCl4═Ti+4NaCl,
故答案为:4Na+TiCl4═Ti+4NaCl;
(4)电镀废渣(除镍外,还含有铜、锌、铁等元素),过滤后在滤液中加入FeS,生成CuS、ZnS,可除去Cu2+、Zn2+等杂质,对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+生成Fe3+,有利于水解生成氢氧化铁沉淀而除去,过滤后在滤液中加入碳酸钠,可生成NiCO3,过滤后加入硫酸可生成NiSO4,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体,
①FeS除去Cu2+的反应是沉淀的转化,即FeS+Cu2+=CuS+Fe2+,
故答案为:FeS+Cu2+=CuS+Fe2+;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+,
故答案为:氧化Fe2+;除去Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶,
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4).
点评 本题考查较为综合,涉及氧化还原反应、盐类的水解、物质的分离提纯以及原电池知识,为高频考点,侧重于学生的分析能力和实验能力的考查,为高频考点和常见题型,题目难度中等,注意把握基础知识的积累.

 阅读快车系列答案
阅读快车系列答案| A. | “钴酞菁”分子所形成的分散系不具有丁达尔效应 | |
| B. | “钴酞菁”分子不能透过滤纸 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
| A. | 在氧化还原反应中,氧化剂经化学变化变成还原产物 | |
| B. | 在氧化还原反应中,氧化剂被氧化,还原剂被还原 | |
| C. | 在化学反应中,能把其他物质氧化的物质是氧化剂 | |
| D. | 氧化还原反应的本质是电子得失或电子对的偏移 |
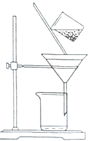
| A. | 漏斗末端颈尖未紧靠烧杯壁 | |
| B. | 玻璃棒用作引流 | |
| C. | 将滤纸湿润,使其紧贴漏斗壁 | |
| D. | 滤纸边缘高出漏斗 | |
| E. | 用玻璃棒在漏斗中轻轻搅动以加快过滤速度. |
| A. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| B. | 在25℃、1.01×105 Pa时,11.2 L N2所含的原子数为NA | |
| C. | 18g水中所含的质子数为8NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
| A. | 量筒 | B. | 试管 | C. | 圆底烧瓶 | D. | 烧杯 |
| 物 质 | 选用试剂(过量) | 操作方法 | |
| A | CaO(CaCO3) | 水 | 过滤 |
| B | CuO(Fe) | 稀盐酸 | 加入稀盐酸充分反应后过滤 |
| C | CuSO4溶液(H2SO4) | 氧化铜 | 加入氧化铜粉末充分反应后过滤 |
| D | 盐酸(H2SO4) | 硝酸钡溶液 | 加入硝酸钡溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色沉淀,继续通入CO2气体,白色沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液. |
| B | 某无色晶体加入NaOH浓溶液中并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| C | 用蒸馏法能将溶解在CCl4中的碘单质分离出来 | 因为碘易升华,故蒸馏时先分离出来 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2>F e3+ |
| A. | A | B. | B | C. | C | D. | D |