题目内容
17.下列实验操作的描述中,正确的是( )| A. | 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物 | |
| C. | 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量 | |
| D. | 利用丁达尔效应可以区别溶液和胶体 |
分析 A.过量试剂不能放回原瓶;
B.氯化钠和硝酸钾均溶于水;
C.NaOH易潮解,具有腐蚀性;
D.丁达尔现象为胶体特有的性质.
解答 解:A.过量试剂不能放回原瓶,防止试剂污染,故A错误;
B.氯化钠和硝酸钾均溶于水,应选结晶法分离,故B错误;
C.NaOH易潮解,具有腐蚀性,应在左盘小烧杯中称量,故C错误;
D.丁达尔现象为胶体特有的性质,则丁达尔效应可以区别溶液和胶体,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、混合物分离提纯、物质的鉴别为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
7.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| B. | 在25℃、1.01×105 Pa时,11.2 L N2所含的原子数为NA | |
| C. | 18g水中所含的质子数为8NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
8.常温下,在无色透明的酸性溶液中一定能大量共存的离子组是( )
| A. | Na+、NH4+、SO42-、NO3- | B. | Na+、K+、SO42-、Cu2+ | ||
| C. | Ca2+、K+、Cl-、CO32- | D. | Mg2+、Fe3+、OH-、Cl- |
5.用如图所示装置进行如下实验,不能达到实验目的是( )
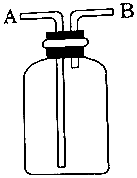

| A. | A瓶中盛满水,从B口进气,用排水法收集O2 | |
| B. | 瓶中盛适量浓硫酸,从A口进气来干燥Cl2 | |
| C. | 从B口进气,用排空气法收集Cl2 | |
| D. | 瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的大约体积 |
12.下列实验的现象、解释或结论正确的是( )
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色沉淀,继续通入CO2气体,白色沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液. |
| B | 某无色晶体加入NaOH浓溶液中并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| C | 用蒸馏法能将溶解在CCl4中的碘单质分离出来 | 因为碘易升华,故蒸馏时先分离出来 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2>F e3+ |
| A. | A | B. | B | C. | C | D. | D |
2.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定会有CO32- | |
| B. | 某溶液中滴加了Na2CO3溶液,生成白色沉淀,该溶液中一定会有Ba2+ | |
| C. | 某无色溶液滴加酚酞试液显红色,该溶液不一定是碱液 | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀HCl除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
