题目内容
15. 电解饱和食盐水装置的结构如图所示:
电解饱和食盐水装置的结构如图所示:(1)在电解食盐水之前,需要提纯食盐水.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是C.
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
A、①④②⑤③B、④①②⑤③C、②⑤④①③D、⑤②④③①
(2)铁棒的现象:有气泡产生,滴入酚酞变红,说明有NaOH生成.石墨棒的现象:有黄绿色气体产生,能使湿润的淀粉碘化钾试纸变蓝,电解食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$NaOH+Cl2↑+H2↑.
分析 (1)除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子和钙离子,即必须满足碳酸钠溶液应该在加入氯化钡溶液之后;
(2)电解饱和食盐水,铁棒余电源负极相连为阴极,则水中的氢离子放电,产生氢氧根离子,遇酚酞变红色,石墨棒与电源正极相连为阳极,氯离子放电产生氯气,据此分析.
解答 解:(1)要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完,再进行过滤,最后加盐酸除去过量的氢氧根离子和碳酸根离子,顺序为:②⑤④①③或⑤②④①③.
故选C;
(2)电解饱和食盐水,铁棒余电源负极相连为阴极,则水中的氢离子放电,产生氢氧根离子,遇酚酞变红色,所以铁棒的现象:有气泡产生,滴入酚酞变红,说明有NaOH生成;石墨棒与电源正极相连为阳极,氯离子放电产生氯气,氯气与碘化钾所应生成碘单质,使淀粉变蓝,所以石墨棒的现象有黄绿色气体产生,能使湿润的淀粉碘化钾试纸变蓝,电解食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$NaOH+Cl2↑+H2↑;故答案为:有气泡产生;变红;NaOH;有黄绿色气体产生;变蓝;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$NaOH+Cl2↑+H2↑.
点评 本题主要考查了在粗盐提纯中的物质的除杂以及电解原理,在解此类题时,首先要了解需要除去的是哪些离子,然后选择适当的试剂进行除杂,在除杂质时,要注意加入试剂的量的控制及顺序.

| A. | 铁跟盐酸的反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铵固体和熟石灰共热:NH4++OH═-NH3↑+H2O | |
| C. | 向碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应:Fe3++3OH-═Fe(OH)3↓ |
| A. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| B. | 在25℃、1.01×105 Pa时,11.2 L N2所含的原子数为NA | |
| C. | 18g水中所含的质子数为8NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
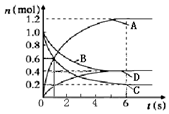 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应推断合理的是( )| A. | 该反应的化学方程式为3B+4C=6A+2D | |
| B. | 反应进行到1s时,3v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的质量分数不变 | |
| D. | 反应进行到6s时,B的平均反应速率为0.1mol/(L•s) |
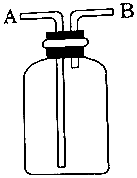
| A. | A瓶中盛满水,从B口进气,用排水法收集O2 | |
| B. | 瓶中盛适量浓硫酸,从A口进气来干燥Cl2 | |
| C. | 从B口进气,用排空气法收集Cl2 | |
| D. | 瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的大约体积 |
 ,还可以写成
,还可以写成 ,1mol苯可以跟3molH2发生加成反应生成环己烷,环己烷的结构简式为
,1mol苯可以跟3molH2发生加成反应生成环己烷,环己烷的结构简式为 .
.