题目内容
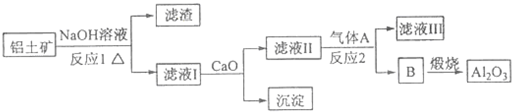
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:下列推断合理的是( )


| A、甲为CO2;乙为NH3 |
| B、由滤液提纯(NH4)2SO4过程中的实验操作为萃取 |
| C、CO2可被循环使用 |
| D、上述过程中涉及到的反应全部是氧化还原反应 |
考点:制备实验方案的设计,物质的分离、提纯的基本方法选择与应用
专题:
分析:制备(NH4)2SO4,由制备流程可知,往CaSO4悬浊液中加入气体甲(NH3),增大气体乙(CO2)的溶解度,有利于生成(NH4)2SO4,过滤得到的碳酸钙,碳酸钙分解生成的二氧化碳可循环使用,对滤液通入氨气蒸发结晶可得到(NH4)2SO4,以此来解答.
解答:
解:A.往CaSO4悬浊液中加入NH3后,发生反应如下:CaSO4+2NH3+2H2O Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则甲为NH3,故A错误;
Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则甲为NH3,故A错误;
B.(NH4)2SO4是强酸弱碱盐,容易水解,滤液通入氨气蒸发结晶可得到(NH4)2SO4,不能使用萃取,故B错误;
C.生成的CaCO3又可煅烧制取CO2可以在第二步循环利用,故C正确;
D.CaSO4+2NH3+2H2O Ca(OH)2+(NH4)2SO4及碳酸钙的生成和分解中均没有元素的化合价变化,均为非氧化还原反应,故D错误.
Ca(OH)2+(NH4)2SO4及碳酸钙的生成和分解中均没有元素的化合价变化,均为非氧化还原反应,故D错误.
故选C.
 Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则甲为NH3,故A错误;
Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则甲为NH3,故A错误;B.(NH4)2SO4是强酸弱碱盐,容易水解,滤液通入氨气蒸发结晶可得到(NH4)2SO4,不能使用萃取,故B错误;
C.生成的CaCO3又可煅烧制取CO2可以在第二步循环利用,故C正确;
D.CaSO4+2NH3+2H2O
 Ca(OH)2+(NH4)2SO4及碳酸钙的生成和分解中均没有元素的化合价变化,均为非氧化还原反应,故D错误.
Ca(OH)2+(NH4)2SO4及碳酸钙的生成和分解中均没有元素的化合价变化,均为非氧化还原反应,故D错误.故选C.
点评:本题考查制备使实验方案的设计,为高频考点,把握制备流程中使用的试剂及发生的反应为解答的关键,侧重实验流程分析能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于反应:X(s)+3Y(g)?2Z(g)△H<0,下列说法正确的是( )
| A、该反应较高温度下不容易自发进行,在低温下容易自发进行 |
| B、增大压强,X、Y、Z浓度均增大,正、逆反应速率均加快 |
| C、升高温度,反应活化能降低,反应速率加快 |
| D、其他条件不变,增大反应物浓度,平衡常数增大 |
下列化学反应的速率,一定是前者大于后者的( )
A、反应A+B
| ||||
| B、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| C、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 | ||||
| D、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
下列各组离子在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、NO3-、OH- |
| C、H+、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
下列图示装置的实验中,操作正确的是( )


| A、图1配制250 mL 0.10 mol?L-1盐酸 |
| B、图2稀释浓硫酸 |
| C、图3称量氯化钠固体 |
| D、图4检验铁粉与水蒸气反应产生的氢气 |
T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示.则下列结论正确的是( )
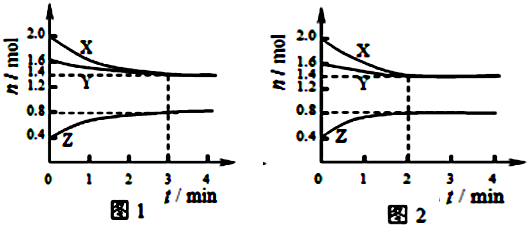

| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| C、若改变反应条件,使反应进程如图2所示,则改变的条件是增大压强 |
| D、如图1所示,该反应达到化学平衡时,X的转化率为70% |
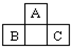 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答: