题目内容
A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等.B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍.请填写下列空格:
(1)推断A、B、C、D四种元素的符号A ;B ;C ;D ;
(2)C的一价阴离子的结构示意图 ;
(3)D元素的最高价氧化物的结构式是 ;
(4)C、D两元素形成的化合物电子式 ,分子内含有 键 (填极性或非极性).
(5)用电子式表示A、C两元素形成的化合物的过程 .
(1)推断A、B、C、D四种元素的符号A
(2)C的一价阴离子的结构示意图
(3)D元素的最高价氧化物的结构式是
(4)C、D两元素形成的化合物电子式
(5)用电子式表示A、C两元素形成的化合物的过程
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D中,0.5mol A元素的离子得到NA个电子被还原为中性原子,则A离子带两个单位正电荷,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,HCl的物质的量=0.1L×0.2mol/L=0.02mol,由AO+2HCl═ACl2+H2O,可知0.4gAO的物质的量为0.01mol,则M(AO)=
=40g/mol,故A的摩尔质量为40g/mol-16g/mol=24g/mol,A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,即D为C元素,以此解答.
| 0.4g |
| 0.01mol |
解答:
解:短周期元素A、B、C、D中,0.5mol A元素的离子得到NA个电子被还原为中性原子,则A离子带两个单位正电荷,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,HCl的物质的量=0.1L×0.2mol/L=0.02mol,由AO+2HCl═ACl2+H2O,可知0.4gAO的物质的量为0.01mol,则M(AO)=
=40g/mol,故A的摩尔质量为40g/mol-16g/mol=24g/mol,A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al;C-比A元素的离子多1个电子层,则C的质子数为18-1=17,即C为Cl元素;D元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,即D为C元素,综上所述:A为镁,B为铝,C为氯,D为碳,
(1)A为Mg,B为Al,C为Cl,D为C,故答案为:Mg;Al;Cl;C;
(2)Cl的质子数为17,离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)D为碳元素,最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式为O=C=O,故答案为:O=C=O;
(4)Cl、C两元素形成的化合物为CCl4,电子式为 ,分子内含有极性键,故答案为:
,分子内含有极性键,故答案为: ;极性;
;极性;
(5)Mg、Cl两元素形成的化合物为MgCl2,MgCl2为离子化合物,用电子式表示的形成过程为 ,
,
故答案为: .
.
| 0.4g |
| 0.01mol |
(1)A为Mg,B为Al,C为Cl,D为C,故答案为:Mg;Al;Cl;C;
(2)Cl的质子数为17,离子结构示意图为
 ,故答案为:
,故答案为: ;
;(3)D为碳元素,最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式为O=C=O,故答案为:O=C=O;
(4)Cl、C两元素形成的化合物为CCl4,电子式为
 ,分子内含有极性键,故答案为:
,分子内含有极性键,故答案为: ;极性;
;极性;(5)Mg、Cl两元素形成的化合物为MgCl2,MgCl2为离子化合物,用电子式表示的形成过程为
 ,
,故答案为:
 .
.
点评:本题考查位置结构性质关系及其应用,侧重对化学用语的考查,推断元素是解答关键,题目难度中等.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
下列化学反应的速率,一定是前者大于后者的( )
A、反应A+B
| ||||
| B、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| C、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 | ||||
| D、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
下列叙述正确的是( )
| A、氯气、SO2都具有氧化性,故而可用于漂白纸浆等 |
| B、常温下浓硫酸能与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| C、H2CO3是弱酸,所以NaHCO3是弱电解质 |
| D、较强的酸可以制取较弱的酸,次氯酸溶液无法制取盐酸 |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
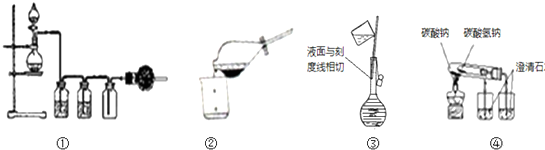

| A、①可用于实验室用MnO2固体与浓盐酸反应,制取并收集干燥、纯净的Cl2 |
| B、②从溴水中萃取溴后的分离操作 |
| C、③配制1mol/LNaCl溶液定容操作 |
| D、用图④操作可比较Na2CO3与NaHCO3的热稳定性 |
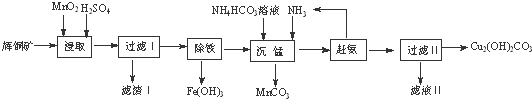



 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答: