题目内容
8. 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时,放出的热量为69.15kJ.
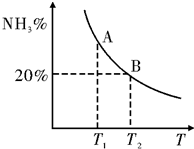
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示.由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1>K2 (填“>”或“<”).若在恒温、恒压条件下,向平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”).
②见右图,T2温度时,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,则v(H2)=0.09mol/(L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡向右移动(填“向左”、“向右”或“不”).
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,在一定压强下测得如下数据:
| 温度/℃ CO2转化率% $\frac{n(N{H}_{3})}{n(C{O}_{2})}$ | 100 | 150 | 200 |
| 1 | 19.6 | 27.1 | 36.6 |
| 1.5 | a | b | c |
| 2 | d | e | f |
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?净化后重新充入合成塔内,循环利用,提高原料利用率.
分析 (1)依据热化学方程式定量关系计算分析,氨气的物质的量n=$\frac{V}{{V}_{m}}$,然后结合热化学方程式计算得到;
(2)①图象分析,A点氨气含量大于B点,说明温度越高,氨气含量越少,平衡逆向进行,平衡常数减小,恒温恒压加入惰性气体,体积增大压强减小,平衡向气体体积增大的分析进行,逆向进行;
②依据平衡转化率计算生成的氨气,结合平衡三段式列式计算,反应速率v$\frac{△c}{△t}$,依据平衡常数概念和平衡浓度计算得到,依据题干浓度计算浓度商和平衡常数比较;
(3)①分析图表当氨气和二氧化碳物质的量之比等于1,随温度升高,CO2转化率增大,说明反应正向进行,正向是吸热反应,氨气和二氧化碳物质的量之比增大,平衡正向进行,二氧化碳转化率增大,依据化学平衡影响因素和平衡三段式分析判断;
②循环利用原料.
解答 解:(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.在一定条件下反应时,当生成标准状况下33.6L NH3时物质的量=$\frac{33.6L}{22.4L/mol}$=1.5mol,放出的热量=$\frac{1.5mol×92.2kJ}{2mol}$=69.15kJ,
故答案为:69.15kJ;
(2)①图象分析,A点氨气含量大于B点,说明温度越高,氨气含量越少,平衡逆向进行,平衡常数减小,温度T1、T2时的平衡常数分别为K1、K2,则K1>K2,恒温恒压加入惰性气体,体积增大压强减小,平衡向气体体积增大的分析进行,逆向进行,平衡向左移动,
故答案为:>;向左;
②T2温度时,图象分析可知,平衡时氨气含量为20%,在1L的密闭容器中加入2.1mol N2、1.5mol H2,经10min达到平衡,设消耗氮气浓度为x,
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 2.1 1.5 0
变化量(mol/L) x 3x 2x
平衡量(mol/L) 2.1-x 1.5-3x 2x
平衡时氨气含量为20%,$\frac{2x}{3.6-2x}$=20%,解得:x=0.3mol/L,
则v(H2)=$\frac{3×0.3mol/L}{10min}$=0.09 mol•L-1•min-1;
平衡浓度c(NH3)=0.6mol/L,c(H2)=0.6mol/L,c(N2)=1.8mol/L,
该反应的平衡常数为:K=$\frac{0.{6}^{2}}{0.{6}^{3}×1.8}$=0.93,
达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,个物质浓度为:(NH3)=0.6mol/L+0.4mol/L=1mol/L,c(H2)=0.6mol/L+0.4mol/L=1mol/L,c(N2)=1.8mol/L+0.4mol/L=2.2mol/L,
Q=$\frac{{1}^{2}}{{1}^{3}×2.2}$=0.45<K=0.93,则此时反应正向进行,
故答案为:0.09;向右;
(3)①分析图表当氨气和二氧化碳物质的量之比等于1,随温度升高,CO2转化率增大,说明反应正向进行,正向是吸热反应,△H>0;氨气和二氧化碳物质的量之比增大,平衡正向进行,二氧化碳转化率增大,a<d,依据图表数据反应是吸热反应,b<c,e<f,b<e,得到b<f,
故答案为:>;<;<;
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应净化后重新充入合成塔内,循环利用,提高原料利用率,
故答案为:净化后重新充入合成塔内,循环利用,提高原料利用率.
点评 本题考查了热化学方程式计算,图象分析判断化学平衡、反应速率、平衡常数计算应用等知识,掌握平衡移动原理是关键,注意掌握化学平衡及其影响因素,明确热化学方程式的书写原则.

| A. | 相同物质的量的气体,其气体摩尔体积也相同 | |
| B. | 气体摩尔体积是指1mol任何气体所占的体积为22.4L | |
| C. | 标准状况下的气体摩尔体积约为22.4L/mol | |
| D. | 一定物质的量的气体所占的体积就是气体摩尔体积 |
| A. | Fe2+、Ca2+、Cl-、NO3- | B. | Na+、AlO2-、Cl-、SO42- | ||
| C. | K+、Ba2+、Cl-、NO3- | D. | Fe3+、Al3+、Cl-、SCN- |
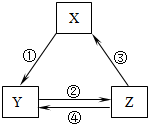 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z |
| A | CaO | Ca(OH)2 | CaCO3 |
| B | AlCl3 | NaAlO2 | Al(OH)3 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
[查阅文献]
| 文献名称 | 有关Fe(OH)2的描述 |
| 《大学普通化学(下册)》 | 白色沉淀,易被氧化成微绿色Fe3(OH)8 |
| 《化学教育》 | 白色沉淀,在冷水中易形成绿色的水合物Fe(OH)2•nH2O,热水中不易形成水合物 |
[提出假设]假设一:绿色物质是Fe(OH)2•nH2O;
假设二:绿色物质是Fe3(OH)8;
…
[实验探究]针对上述假设与假设二,展开实验研究:
| 实验序号 | 实验步骤 | 实验现象 |
| 一 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②保持较高温度,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色絮状沉淀,并能保持一段时间 |
| 二 | ①在试管中加入20mL蒸馏水 ②加入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为灰绿色,最后变为红褐色 |
| 三 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②恢复室温后,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为绿色沉淀 |
(2)由实验一与实验三(填实验序号)的现象可推断假设一可能成立.
(3)为了进一步探究假设二是否成立,小组成员进行如下实验,请完成下表:
试剂:蒸馏水、NaOH溶液、苯、FeSO4溶液、氧气
| 实验步骤 | 实验现象与结论 |
| ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②迅速用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 ③将O2缓缓通入白色沉淀中. | 若沉淀中出现绿色的迹象,则假设二成立; 若沉淀中没有出现任何绿色的迹象,则假设二不成立. |
| A. | 0.1 mol•L-1 NaHCO3溶液中:[Na+]+[H+]═[HCO3-]+2[CO32-]+[OH-] | |
| B. | 0.1 mol•L-1Na2S溶液中:2[Na+]═[S2-]+[HS-]+[H2S] | |
| C. | 0.1 mol•L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] | |
| D. | 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |


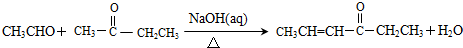
 ,其反应类型是加成反应.
,其反应类型是加成反应.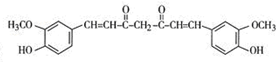 .
.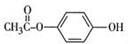 .
. A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验: