题目内容
3.下列反应的离子方程式中,书写正确的是( )| A. | 实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32-═CO2↑+H2O | |
| B. | 氯化铝中加入氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 硫酸铜与氢氧化钡溶液反应:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
分析 A.碳酸钙在离子反应中保留化学式;
B.反应生成氢氧化铝和氯化铵;
C.电子、电荷不守恒;
D.反应生成硫酸钡和氢氧化铜.
解答 解:A.实验室用大理石跟稀盐酸制取二氧化碳的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故A错误;
B.氯化铝中加入氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故B错误;
C.铁粉与氯化铁溶液反应的离子反应为Fe+2Fe3+═3Fe2+,故C错误;
D.硫酸铜与氢氧化钡溶液反应的离子反应为Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
13.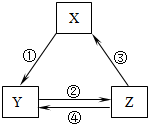 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z |
| A | CaO | Ca(OH)2 | CaCO3 |
| B | AlCl3 | NaAlO2 | Al(OH)3 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
14.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
11.氢气还原氧化铜:CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,在该反应中( )
| A. | CuO做氧化剂 | B. | Cu做还原剂 | ||
| C. | 铜是氧化产物 | D. | 铜元素化合剂升高 |
18.下列溶液中各微粒的浓度关系正确的是( )
| A. | 0.1 mol•L-1 NaHCO3溶液中:[Na+]+[H+]═[HCO3-]+2[CO32-]+[OH-] | |
| B. | 0.1 mol•L-1Na2S溶液中:2[Na+]═[S2-]+[HS-]+[H2S] | |
| C. | 0.1 mol•L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] | |
| D. | 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |
16.绿柱石被国际珠宝界公认为四大名贵宝石之一.主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿.试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是3p,基态Cr原子的价电子排布式是3d54s1.
(2)用“>”或“<”填空:
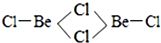
(3)BeCl2分子的空间构型是直线型,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是sp3.
(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式SiH4+2O2=SiO2+2H2O.
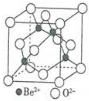
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg•cm-3,则晶胞连长为$\root{3}{\frac{100}{ρ{N}_{A}}}$cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示).
(1)基态Al原子中,电子填充的最高能级是3p,基态Cr原子的价电子排布式是3d54s1.
(2)用“>”或“<”填空:
| 第一电离能 | 键能 | 沸点 | 离子半径 |
| Be>B | C-C>Si-Si | H2S<H2O | Al3+<O2- |

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式SiH4+2O2=SiO2+2H2O.
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg•cm-3,则晶胞连长为$\root{3}{\frac{100}{ρ{N}_{A}}}$cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示).

17.亚硝酸钠(NaNO2)是重要的防腐剂.某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成.
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
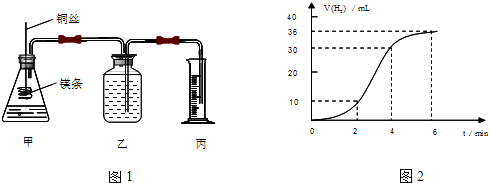
以碳和浓硝酸为起始原料,设计如图1装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(反应方程式为2NO+Na2O2═2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
(3)第一组实验数据出现异常,造成这种异常的原因可能是A、C(填字母).
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(5)亚硝酸钠易溶于水,将0.2mol•L-1的亚硝酸钠溶液和0.1mol•L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-).
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理.25℃时,反应进行10min,溶液的pH由7变为12.电化学降解NO3-的原理如图2所示.
(6)电源正极为A(填A或B),阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如图1装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(反应方程式为2NO+Na2O2═2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(5)亚硝酸钠易溶于水,将0.2mol•L-1的亚硝酸钠溶液和0.1mol•L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-).
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理.25℃时,反应进行10min,溶液的pH由7变为12.电化学降解NO3-的原理如图2所示.
(6)电源正极为A(填A或B),阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.