题目内容
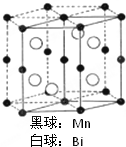 磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )
磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )| A、Mn2Bi |
| B、MnBi |
| C、MnBi3 |
| D、Mn4Bi3 |
考点:晶胞的计算
专题:化学键与晶体结构
分析:由图可知,Mn位于顶点、面心、体心和棱心,Bi位于体内,利用均摊法计算.
解答:
解:Mn位于顶点、面心、体心和棱心,数目为:2×
+12×
+1+6×
=6,Bi位于体内,数目为6,则化学式可写为:MnBi,故选B.
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 3 |
点评:本题考查均摊法计算化学式,难度不大,能判断出各种微粒所在晶胞位置.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
在乙烯分子中有σ键和π键,下列说法不正确的是( )
| A、中心原子采用sp2杂化 |
| B、乙烯分子中有4个σ键和2个π键 |
| C、杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| D、乙烯分子中所有原子一定在同一平面 |
某澄清透明溶液中可能含有:NH4+、Ba2+、Al3+、Fe2+、SO32-、SO42-、HCO3-中的几种离子.为确定溶液组成,进行如下实验:
①测定溶液的pH,溶液显强酸性.滴加Ba(NO3)2(aq)出现白色沉淀.
②取少量溶液加入NaOH(aq)至强碱性,产生刺激性气味的气体并得到澄清溶液.
③在②的澄清溶液中通入足量CO2,有白色沉淀生成.
由此,正确的推测是( )
①测定溶液的pH,溶液显强酸性.滴加Ba(NO3)2(aq)出现白色沉淀.
②取少量溶液加入NaOH(aq)至强碱性,产生刺激性气味的气体并得到澄清溶液.
③在②的澄清溶液中通入足量CO2,有白色沉淀生成.
由此,正确的推测是( )
| A、一定有Al3+离子 |
| B、可能有HCO3-离子 |
| C、不能确定SO32-离子是否存在 |
| D、不存在Fe2+离子,可能存在Ba2+离子 |
工业上可以用二氧化碳与氢气在催化剂的作用下反应生成甲醇,反应方程式为:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g),C=O键能为a kJ/mol,H-H 键能为b kJ/mol,
C-O键能为c kJ/mol,H-C键能为d kJ/mol,H-O键能为e kJ/mol,则该反应的反应热为( )
CO2(g)+3H2(g)═CH3OH(g)+H2O(g),C=O键能为a kJ/mol,H-H 键能为b kJ/mol,
C-O键能为c kJ/mol,H-C键能为d kJ/mol,H-O键能为e kJ/mol,则该反应的反应热为( )
| A、2a+3(b+d-e)+c kJ/mol |
| B、a+3(2b+d-e)-c kJ/mol |
| C、3(d+e-b)+c-2a kJ/mol |
| D、2a+3(b-d-e)-c kJ/mol |
| E、2a+3(b-d-e)-c kJ/mol |
下列图示的操作中,正确的是( )
A、 加热液体 |
B、 熄灭酒精灯 |
C、 读取液体体积 |
D、 过滤 |
在下列各项中,化学反应前后肯定没有发生改变的是( )
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
| A、①③④⑤ | B、①③④⑥ |
| C、①④⑥ | D、①③⑤ |
