题目内容
将5.6g铁粉放入一定量某浓度的硝酸溶液中,待铁粉全部溶解后,共收集到NO、NO2(其他气体忽略不计)混合气体0.15mol,该混合气体中NO与NO2的体积比可能是( )
| A、1:2 | B、2:1 |
| C、3:2 | D、3:1 |
考点:化学方程式的有关计算
专题:计算题
分析:铁粉和一定量某浓度的硝酸反应生成二氧化氮,和稀硝酸反应生成NO,根据转移电子守恒计算二氧化氮和NO的物质的量;
解答:
解:铁粉放入一定量某浓度的硝酸溶液中,发生反应Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O,Fe+6HNO3(浓)=Fe(NO3)3+3NO2↑+3H2O,3Fe+8HNO3(稀)=3Fe(NO3)2+NO↑+4H2O,Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,
5.6g铁粉的物质的量为:n=
=
=0.1mol,设生成的NO的物质的量为xmol,NO2的物质的量为ymol,NO、NO2(其他气体忽略不计)混合气体0.15mol,x+y=0.15mol,反应中铁失去的电子总数等于硝酸得到的电子总数,
当生成三价铁时,3×x+y×1=0.1mol×3,解得:x=0.075,y=0.075,同等条件下,气体体积比等于物质的量之比,所以该混合气体中NO与NO2的体积比1:1,
当生成二价铁时,3×x+y×1=0.1mol×2,解得:x=0.025,y=0.125,同等条件下,气体体积比等于物质的量之比,所以该混合气体中NO与NO2的体积比1:5,
当生成既有三价铁又有二价铁时,该混合气体中NO与NO2的体积比介于1:1与1:5之间,
故选A.
5.6g铁粉的物质的量为:n=
| m |
| M |
| 5.6g |
| 56g/mol |
当生成三价铁时,3×x+y×1=0.1mol×3,解得:x=0.075,y=0.075,同等条件下,气体体积比等于物质的量之比,所以该混合气体中NO与NO2的体积比1:1,
当生成二价铁时,3×x+y×1=0.1mol×2,解得:x=0.025,y=0.125,同等条件下,气体体积比等于物质的量之比,所以该混合气体中NO与NO2的体积比1:5,
当生成既有三价铁又有二价铁时,该混合气体中NO与NO2的体积比介于1:1与1:5之间,
故选A.
点评:本题考查硝酸的性质,难度中等,侧重于学生的分析能力和计算能力的考查,注意理解反应的实质,结合方程式利用原子、得失电子守恒进行的计算.

练习册系列答案
相关题目
分离下列三组混合物依次采取的方法正确的是:①植物油和氯化钠溶液 ②碳酸钙和氯化钙的水溶液 ⑧氯化钠和碘( )
| A、分液、蒸馏、萃取 |
| B、蒸发、过滤、分液 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
运用元素周期律分析下面的推断正确的是( )
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 |
| C、硫酸锶难溶于水,但易溶于盐酸 |
| D、铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性 |
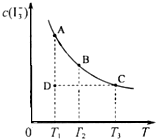 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq) 某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H>0 |
| B、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 |
| C、若反应进行到状态D时,平衡向逆反应方向移动 |
| D、状态B与状态C相比,状态C的c(I2)大 |
在2L密闭容器中加入或通入一定量A、B、C三种物质,在一定条件下发生反应(如图1),3min后给体系加热,气体C的体积分数Ψ(C)和混合气体的平均相对分子质量M均随温度分别发生了图示变化(如图2、图3).下列有关说法不正确的是( )
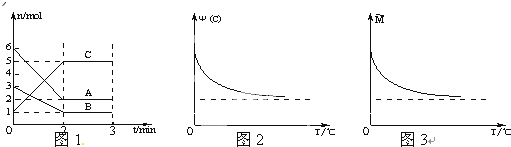

| A、前2min中C的平均反应速率为1mol/L?min |
| B、该反应的化学方程式为:2A+B?2C |
| C、正反应是放热反应 |
| D、A、B一定均为气态 |
某氯化镁溶液的密度为1.2g?cm-3,其中镁离子的质量分数为5%,300mL该溶液中Cl-离子的物质的量约为( )
| A、0.37 mol |
| B、0.63mol |
| C、0.75mol |
| D、1.5mol |
向CuSO4的溶液中投入一小块金属钠,可观察到的现象是(双选)( )
| A、有较多的铜析出 |
| B、有气体产生 |
| C、有蓝色沉淀产生 |
| D、有白色沉淀产生 |
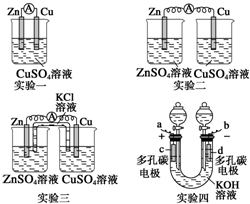 某校化学兴趣小组为了探究原电池工作原理,进行下列实验,请分析实验结果后回答相应问题.
某校化学兴趣小组为了探究原电池工作原理,进行下列实验,请分析实验结果后回答相应问题.